Oprema za proizvodnju azota. Dobijanje azota Proizvodnja azota iz vazduha
Budući da se slobodni dušik nalazi u atmosferi, njegova proizvodnja se svodi na odvajanje od kisika i drugih komponenti zraka. To se radi postepenim isparavanjem tekućeg zraka u posebnim instalacijama, a istovremeno se proizvode kisik i inertni plinovi.
Azot je gas bez boje i mirisa (t.t. -210°C, bp -196°C). Njegova rastvorljivost u vodi je niska - oko 2% zapremine. Molekula dušika je dvoatomska i ne raspada se primjetno na atome čak i na vrlo visokim temperaturama.
Slobodni azot je hemijski veoma inertan. U normalnim uslovima, ne reaguje sa metaloidima ili metalima (osim Li). Sa povećanjem temperature, njegova aktivnost raste uglavnom u odnosu na metale, s nekima od kojih se kombinuje pri zagrijavanju, formirajući nitride ovih metala (na primjer, Mg 3 N 2).
3Mg + N 2 = Mg 3 N 2
Upotreba slobodnog dušika, kao takvog, prilično je ograničena. Uglavnom se koristi za punjenje električnih lampi. Jedinjenja dušika su od velikog značaja za biologiju i koriste se u raznim industrijama. Najveće količine se troše kao mineralna đubriva i u proizvodnji eksploziva.
Glavni polazni proizvod za industrijsku proizvodnju azotnih spojeva je slobodni dušik iz zraka. Njegovo prevođenje u vezano stanje se uglavnom provodi metodom sinteze amonijaka, razvijenom 1913. godine.
Primjena na reverzibilnu reakciju
N 2 + ZN 2< = >2NH 3 + 22 kcal
Princip pomeranja ravnoteže pokazuje da su najpovoljniji uslovi za stvaranje amonijaka najniža moguća temperatura i najveći mogući pritisak. Međutim, čak i na 700°C brzina reakcije je tako niska (i stoga se ravnoteža uspostavlja tako sporo) da ne može biti govora o njenoj praktičnoj upotrebi. Naprotiv, na višim temperaturama, kada se brzo uspostavi ravnotežno stanje, sadržaj amonijaka u sistemu postaje zanemarljiv. Stoga se ispostavlja da je tehnička implementacija procesa koji se razmatra nemoguća, jer ubrzavanjem postizanja ravnoteže uz pomoć zagrijavanja istovremeno pomjeramo položaj ravnoteže na nepovoljnu stranu.
Međutim, postoji način da se ubrza postizanje ravnotežnog stanja bez istovremenog pomjeranja ravnoteže. Ovo često pomaže pri upotrebi odgovarajućeg katalizatora.
Metalno gvožđe (sa dodatkom Al 2 O 3 i K 2 O) pokazalo se da dobro radi u ovom slučaju.
Proces sinteze amonijaka odvija se na temperaturama od 400-550°C (na katalizatoru) i pritiscima od 100-1000 at.
U ovom slučaju, ravnoteža se uspostavlja prilično brzo. Nakon što se amonijak odvoji od mješavine plina, ovaj se ponovo uvodi u ciklus. Tokom četvrt veka, od 1913. do 1938. godine, godišnja svetska proizvodnja vezanog azota na ovaj način porasla je sa 7 tona na 1.700 hiljada tona. Trenutno je sinteza amonijaka glavna industrijska metoda za proizvodnju vezanog azota.
Od znatno manje industrijske važnosti je cijanamidna metoda razvijena 1901. godine, koja se zasniva na činjenici da na visokim temperaturama kalcijev karbid (dobivan zagrijavanjem mješavine vapna i uglja u električnoj peći) reagira sa slobodnim dušikom prema jednačini
CaC 2 + N 2 = CaCN 2 + C + 70 kcal
Kalcijum cijanamid (Ca = N-C?N) dobijen na ovaj način je sivi prah (od nečistoće ugljenika). Kada je izložena pregrijanoj (tj. zagrijanoj iznad 100°C) vodenoj pari, ona se razgrađuje, oslobađajući amonijak:
CaCN 2 + 3H 2 O = CaCO 3 + 2NH 3
Peć za proizvodnju kalcijum cijanamida je cilindar od vatrostalnog materijala, po čijoj osi prolazi cijev s grijaćim namotom unutra. Nakon punjenja peći usitnjenim CaC 2, ona se čvrsto zatvara i u nju se dovodi dušik. Budući da je stvaranje cijanamida praćeno oslobađanjem topline, dovoljno je početnu smjesu zagrijati na 800°C, a zatim reakcija teče sama. U periodu od 1913. do 1938. godine godišnja svjetska proizvodnja fiksnog dušika cijanamidnom metodom porasla je sa 38 hiljada tona na 300 hiljada tona.
Molekul NH 3 ima oblik trouglaste piramide. Budući da su elektroni H-N veza prilično snažno pomaknuti od vodika do dušika (pNH = 0,28), molekul amonijaka u cjelini karakterizira značajan polaritet (dužina dipola 0,31 A).
Amonijak je bezbojni gas (t.t. -78°C, bp -33°C) sa karakterističnim oštrim mirisom "amonijaka". Njegova rastvorljivost u vodi je veća od rastvorljivosti svih drugih gasova: jedna zapremina vode apsorbuje oko 1200 zapremina NH 3 na 0°C, a oko 700 na 20°C. Komercijalni koncentrovani rastvor obično ima gustinu od 0,91 i sadrži 25% NH 3 po težini.
Poput vode, tečni amonijak se prvenstveno povezuje stvaranjem vodoničnih veza. Dobar je rastvarač za mnoga neorganska i organska jedinjenja.
Povezivanje tečnog amonijaka povezano je sa njegovom visokom toplotom isparavanja (5,6 kcal/mol). Budući da je kritična temperatura NH 3 visoka (+ 133°C) i kada se isparavanjem odvodi mnogo topline iz okoline, tečni amonijak može poslužiti kao dobra radna tvar za rashladne mašine. Kada se klip pomeri udesno, NH 3 zagrejan kompresijom ulazi u zavojnicu, spolja hlađen vodom (ili vazduhom). Ohlađeni amonijak, već na postojećem pritisku u sistemu (7-8 atm), se komprimira i uliva u prijemnik, iz kojeg tečni amonijak ulazi u kalem, gde isparava usled vakuuma u ovom delu sistema. Toplina potrebna za isparavanje apsorbira se iz prostora koji okružuje zavojnicu. Uzastopno ponavljanje čitavog ciklusa procesa stvara kontinuirano hlađenje prostora koji okružuje zavojnicu.
Za hemijske karakteristike amonijaka od primarnog su značaja reakcije tri vrste adicije, supstitucije vodonika i oksidacije.
Najtipičnije reakcije za amonijak su reakcije adicije. Konkretno, kada djeluje na mnoge soli, nastaju kristalna jedinjenja amonijaka sastava CaCl 2 · 8NH 3, CuSO 4 · 4NH 3 itd., slična po prirodi formiranja i stabilnosti kristalnim hidratima.
Kada se amonijak otopi u vodi, djelomično nastaje amonijev hidroksid:
NH 3 + H 2 O< = >NH4OH
U ovom spoju amonijum radikal (NH 4) igra ulogu jednovalentnog metala. Stoga se elektrolitička disocijacija NH 4 OH odvija prema glavnom tipu:
NH4OH< = >NH 4 + + OH -
Kombinirajući obje jednadžbe, dobivamo opću ideju o ravnotežama koje se odvijaju u vodenoj otopini amonijaka:
NH 3 + H 2 O< = >NH4OH< = >NH 4 + + OH -
Zbog prisustva ovih ravnoteža, vodeni rastvor amonijaka (koji se često naziva jednostavno "amonijak") jako miriše na njega. Zbog činjenice da ova otopina sadrži relativno malo OH iona, NH 4 OH se smatra slabom bazom.
Dodavanje kiselina dovodi do pomaka gornje ravnoteže udesno (zbog vezivanja OH iona) i stvaranja amonijumovih soli, na primjer, prema jednadžbi:
NH 4 OH + HCl = H 2 O + NH 4 Cl
Ove soli također nastaju direktnom interakcijom amonijaka s kiselinama, na primjer, reakcijom:
NH3 + HCl = NH4Cl
I sam amonijum jon (NH 4 +) i većina njegovih soli su bezbojni. Gotovo svi su vrlo topljivi u vodi i visoko disocirani u otopinama.
Kada se amonijeve soli zagriju, one se prilično lako razlažu. Priroda razgradnje određena je svojstvima kiseline koja stvara anion. Ako je potonje oksidacijsko sredstvo, amonijak se oksidira prema reakciji, na primjer:
NH 4 NO 2 = 2H 2 O + N 2
Ako kiselina nije oksidant, priroda raspadanja je određena njenom isparljivošću na temperaturi raspadanja. Iz soli nehlapljivih kiselina (na primjer, H 3 PO 4), oslobađa se samo amonijak, ali ako je kiselina hlapljiva (na primjer, HCl), onda se nakon hlađenja ponovo spaja s NH 3. Rezultat takve razgradnje i naknadne rekombinacije se praktično svodi na to da se dotična sol (na primjer, NH 4 Cl) sublimira.
Pod uticajem amonijevih soli: alkalija mulja, amonijak se oslobađa prema reakciji, na primjer:
NH 4 Cl + NaOH = NaCl + NH 4 OH = NaCl + NH 3 + H 2 O
Ovo se može koristiti za laboratorijsku proizvodnju amonijaka, kao i za otkrivanje NH jona u otopini: u potonje se dodaju lužine, a zatim se oslobođeni amonijak detektuje mirisom ili njegovim djelovanjem na vlažni lakmus papir.
Derivati amonijuma su od velike praktične važnosti. Njegov hidroksid (NH 4 OH) jedan je od najvažnijih hemijskih reagensa čiji se razrijeđeni rastvori („amonijak“) ponekad koriste i u domaćinstvu (pri pranju rublja i uklanjanju mrlja). Amonijum hlorid („amonijak“) reaguje sa metalnim oksidima na visokim temperaturama, otkrivajući čistu metalnu površinu. Ovo je osnova za njegovu upotrebu u lemljenju metala. U elektrotehnici se NH 4 Cl koristi za proizvodnju „suhih“ galvanskih ćelija. Amonijum nitrat (NH 4 NO 3) je osnova kompleksnih azotnih đubriva, a koristi se i za pripremu nekih eksplozivnih smeša. Amonijum sulfat [(NH 4) 2 SO 4 ] se u velikim količinama troši u poljoprivredi kao azotno đubrivo. Amonijum karbonat (NH 4 HCO 3) se koristi u pekarstvu (uglavnom u proizvodnji konditorskih proizvoda). Ova njegova upotreba temelji se na činjenici da se prilikom zagrijavanja lako razgrađuje prema shemi
NH 4 HCO 3 = NH 3 ^ + H 2 O + CO 2 ^
a nastali gasovi daju testu potrebnu poroznost. Amonijum sulfid [(NH 4) SO 4 ] je jedan od glavnih reagensa u analitičkoj hemiji. Jedinjenja amonijuma igraju važnu ulogu u nekim proizvodnim procesima hemijske industrije i široko se koriste u laboratorijskoj praksi.
Komercijalni amonijak obično sadrži oko 10% amonijaka. Ima i medicinsku upotrebu. Konkretno, udisanje njegovih para ili oralno uzimanje (3-10 kapi po čaši vode) koristi se za ublažavanje teške intoksikacije. Podmazivanje kože amonijakom slabi efekat ujeda insekata. Prilikom uklanjanja mrlja, sljedeće kompozicije (po zapremini) daju dobre rezultate u mnogim slučajevima:
- a) 4 dijela amonijaka, 5 dijelova etra i 7 dijelova vinskog alkohola;
- b) 10 delova amonijaka, 7 delova vinskog alkohola, 3 dela hloroforma i 80 delova benzina.
Eksplozivna razgradnja amonijum nitrata odvija se uglavnom prema jednačini:
2NH 4 NO 3 = 4H 2 O + O 2 + 57 kcal
Amonal, koji se ponekad koristi u praksi miniranja, je bliska mješavina NH 4 NO 3 (72%), aluminijumskog praha (25%) i uglja (3%). Ova mješavina eksplodira samo od detonacije.
Reakcije supstitucije vodika su manje tipične za amonijak od reakcija adicije o kojima se raspravljalo gore. Međutim, na visokim temperaturama sposoban je zamijeniti svoje vodike metalom, na primjer, reakcijom:
2Al+2NH 3 = 2AlN + ZN 2
Nitridi se najčešće dobijaju zagrijavanjem metala u atmosferi amonijaka. Potonje su čvrste tvari, uglavnom vrlo otporne na toplinu. Nitridi aktivnih metala se manje ili više lako razlažu s vodom, oslobađajući amonijak, na primjer, prema sljedećoj shemi:
Mg 3 N 2 + 6H 2 O = 3Mg(OH) 2 + 2NH 3 ^
Nitridi niskoaktivnih metala u odnosu na vodu su po pravilu vrlo stabilni.
Zbog neisparljivosti nitrida i njihove nerastvorljivosti u bilo kojem od poznatih rastvarača, metode za određivanje molekulske težine koje se primjenjuju na njih još ne postoje. Stoga su poznate samo najjednostavnije formule nitrida. U mnogim od njih prividna valencija metala je kompatibilna s njegovim uobičajenim vrijednostima. U drugim slučajevima, sama najjednostavnija formula ukazuje na složenost molekularne strukture. Prvi tip uključuje, na primjer, Mn 3 N 2, drugi - Cr 2 N.
Kada se u molekulu amonijaka zamijene samo dva atoma vodika, dobijaju se imidi, a kada se zamijeni samo jedan, dobiju se amidi metala. Prvi sadrže dvovalentni radikal = NH (imino grupa), drugi sadrže monovalentni radikal - NH 2 (amino grupa). Na primjer, pri prolasku suhog NH 3 preko zagrijanog metalnog natrijuma prema reakciji
2Na + 2NH 3 = 2NaNH 2 + H 2
nastaje bezbojni natrijum amid, koji je tipična so sa NH 2 anjonom. S vodom se razlaže prema jednačini:
NaNH 2 + H 2 O = NH 3 + NaOH
Natrijum amid se koristi u organskim sintezama.
Uz derivate metala, poznati su proizvodi supstitucije amonijačnih vodonika halogenom. Primjer je dušikov hlorid (NCl 3), koji nastaje u obliku žutih uljastih kapi kada hlor djeluje na jaku otopinu amonijum hlorida:
NH 4 Cl + 3Cl 2 = 4HCl + NCl 3
Pare NCl 3 (t.t. -27°C, t.k. 71°C) imaju oštar miris. Već pri zagrijavanju iznad 90°C (ili udaru), dušikov hlorid se snažnom eksplozijom raspada na elemente.
Kada jod deluje na jak rastvor NH 3, oslobađa se tamnosmeđi talog takozvanog azot-jodida, koji je mešavina NJ 3 sa NHJ 2 i NH 2 J. Azot-jodid je izuzetno nestabilan iu svom suvom obliku , eksplodira na najmanji dodir.
Produkt zamjene jednog od vodonika amonijaka hidroksilnom grupom je hidroksilamin (NH 2 OH). Nastaje tijekom elektrolize dušične kiseline (sa živom ili olovnom katodom) kao rezultat redukcije HNO 3 prema shemi:
HNO 3 + 6H => 2H 2 O + NH 2 OH
Hidroksilamin je bezbojni kristal. Koristi se uglavnom kao redukciono sredstvo.
Sa kiselinama, hidroksilamin (t.t. 33°C) daje soli, od kojih je hlorid (NH 2 OH·HCl) njegov uobičajeni komercijalni pripravak. Sva jedinjenja hidroksilamina su otrovna i općenito su vrlo topljiva u vodi. Oksidirajuća sredstva pretvaraju hidroksilamin u N2 ili N2O, na primjer, reakcijama:
- 2NH 2 OH + HOCl = N 2 +HCl + 3H 2 O
- 6NH 2 OH + 4HNO 3 = 3N 2 O + 4NO + 11H 2 O.
Poput supstitucije vodonika, oksidacijske reakcije za amonijak su relativno rijetke. Ne gori na zraku, ali kada se zapali u atmosferi kisika gori prema jednadžbi:
4NH 3 + ZO 2 = 6H 2 O + 2N 2
Klor i brom snažno reagiraju s amonijakom prema sljedećoj shemi:
2NH 3 + ZG 2 = 6NG + N 2
Oni također oksidiraju amonijak u otopini. U odnosu na većinu drugih oksidansa, NH 3 je stabilan u normalnim uslovima. Najvažniji proizvod parcijalne oksidacije amonijaka je hidrazin (N 2 H 4), koji nastaje reakcijom:
2NH 3 + NaOCl = H 2 O + N 2 H 4 + NaCl
Kao što se može vidjeti iz jednadžbe, pod djelovanjem oksidacijskog sredstva, svaka molekula amonijaka gubi u ovom slučaju jedan atom vodika, a preostali NH 2 radikali se međusobno spajaju. Strukturna formula hidrazina će stoga biti H 2 N-NH 2.
Hidrazin je bezbojna tečnost koja se može mešati sa vodom u bilo kojoj proporciji. Nalazi upotrebu kao redukciono sredstvo.
Dodavanjem kiselina, hidrazin (t.t. 2°C, t.k. 114°C) formira dvije serije soli, na primjer N 2 H 4 HCl i N 2 H 4 2 HCl. Obično se oksidira u slobodni dušik (na primjer, reakcijom:
2K 2 Cr 2 O 7 + 3N 2 H 4 + 8H 2 SO 4 = 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 3N 2 + 14H 2 O)
Para hidrazina pomiješana sa zrakom može izgorjeti u skladu s reakcijom
N 2 H 4 + O 2 => 2H 2 O + N 2 + 149 kcal
To je osnova za njegovu upotrebu kao raketno gorivo. Hidrazin i svi njegovi derivati su otrovni.
Kada hidrazin reagira s dušičnom kiselinom prema shemi
N 2 H 4 + HNO 2 = 2H 2 O + HN 3
Nastaje azotna kiselina (H-N = N?N), koja je bezbojna isparljiva tečnost oštrog mirisa. Jačina azotne kiseline je bliska sirćetnoj kiselini, a rastvorljivost soli (azida) je slična hlorovodoničkoj kiselini. Kao i sam HN 3, neki azidi eksplodiraju nasilno kada se zagriju ili udare. Ovo je osnova za upotrebu olovnog azida kao detonatora, tj. supstanca čija eksplozija izaziva trenutno raspadanje drugih eksploziva.
Kiselinska funkcija HN 3 (t.t. -80°C, bp. +36°C) karakterizira vrijednost K = 3 ·10-5. Njegov eksplozivni raspad prati reakciju:
2NH 3 = H 2 + 3N 2 + 142 kcal
Bezvodna azotna kiselina može eksplodirati čak i jednostavnim protresanjem posude. Naprotiv, u razblaženom vodenom rastvoru se praktično ne raspada tokom skladištenja. Pare HN 3 su vrlo toksične, a njegove vodene otopine izazivaju upalu kože. Azidi su obično bezbojni.
U laboratorijima se dušik može dobiti reakcijom razgradnje amonijum nitrita:
NH 4 NO 2 > N 2 ^ + 2H 2 O+Q
Reakcija je egzotermna, oslobađajući 80 kcal (335 kJ), tako da se posuda mora hladiti dok se odvija (iako se amonijum nitrit mora zagrijati da bi se reakcija pokrenula).
U praksi se ova reakcija izvodi dodavanjem kap po kap zasićene otopine natrijum nitrita u zagrijanu zasićenu otopinu amonijum sulfata, a amonijum nitrit koji nastaje kao rezultat reakcije izmjene trenutno se raspada.
Plin koji se u ovom slučaju oslobađa kontaminiran je amonijakom, dušikovim oksidom (I) i kisikom, od kojih se pročišćava uzastopnim prolaskom kroz otopine sumporne kiseline, željeznog (II) sulfata i preko vrućeg bakra. Azot se zatim suši.
Druga laboratorijska metoda za proizvodnju dušika je zagrijavanje mješavine kalijum dihromata i amonijum sulfata (u omjeru 2:1 po težini). Reakcija se odvija prema jednadžbi:
K 2 Cr 2 O 7 + (NH 4) 2 SO 4 = (NH 4) 2 Cr 2 O 7 + K 2 SO 4
(NH 4) 2 Cr 2 O 7 >(t) Cr 2 O 3 + N 2 ^ + 4H 2 O
Najčišći dušik se može dobiti razgradnjom metalnih azida:
2NaN 3 >(t) 2Na + 3N 2 ^
Takozvani "zračni" ili "atmosferski" dušik, odnosno mješavina dušika s plemenitim plinovima, dobiva se reakcijom zraka s vrućim koksom:
O 2 + 4N 2 + 2C > 2CO + 4N 2
Tako se proizvodi takozvani „generatorski“ ili „vazdušni“ gas – sirovina za hemijsku sintezu i gorivo. Ako je potrebno, dušik se može odvojiti od njega apsorbiranjem ugljičnog monoksida.
Molekularni dušik se industrijski proizvodi frakcijskom destilacijom tekućeg zraka. Ova metoda se takođe može koristiti za dobijanje „atmosferskog azota“. Postrojenja za azot koji koriste metode adsorpcije i membranske separacije plinova također se široko koriste.
Jedna od laboratorijskih metoda je propuštanje amonijaka preko bakar (II) oksida na temperaturi od ~700°C:
2NH3 + 3CuO > N2^ + 3H2O + 3Cu
Amonijak se uzima iz njegove zasićene otopine zagrijavanjem. Količina CuO je 2 puta veća od izračunate. Neposredno prije upotrebe, dušik se prečišćava od kisika i amonijaka prelaskom preko bakra i njegovog oksida (II) (takođe ~700°C), a zatim se suši koncentriranom sumpornom kiselinom i suvim alkalijama. Proces je prilično spor, ali se isplati: dobiveni plin je vrlo čist.
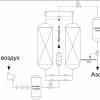
Jedinica za proizvodnju dušika je skup opreme koja koncentriše dušik iz atmosferskog zraka. Maksimalna koncentracija azota na izlazu je 99,9999%. Ovaj indikator se može podesiti ovisno o namjeni plina.
Adsorpcijski generator
Proizvodnja se odvija dovodom komprimovanog vazduha pod pritiskom, koji se pumpa pomoću vijčanog kompresora. Generator je opremljen sistemom za filtriranje i sušačem. Sušač zraka može biti rashladni ili adsorpcijski, ovisno o namjeni i potrebnoj koncentraciji dušika. U procesu proizvodnje komprimovani vazduh prolazi kroz grubo i fino čišćenje i sušenje, pri čemu se postiže tačka rose od +3C i klasa vazduha je u skladu sa ISO 8573-1:2010-1.4.1. Zatim se zrak nakon višestepene filtracije dovodi u generator. Na izlazu azotne opreme dobijamo gotov gas pod pritiskom do 10 bara. Stanica se sastoji od dvije kolone koje sadrže adsorbens za apsorpciju odgovarajuće vrste gasa. Svakih 8-15 godina potrebno je zamijeniti adsorbent, ovisno o uvjetima rada.
Prednosti adsorpcionih generatora azota:
- veliki resursi rada;
- brzo pokretanje/zaustavljanje;
- jednostavnost rada;
- kompaktnost;
- visoka pouzdanost;
- nije potrebna kontrola operatera tokom rada;
- potpuna automatizacija;
- mogućnost daljinskog upravljanja putem web stranice kompanije General Gas.
Membranski generator
Odvajanje plinova se događa zahvaljujući membrani za odvajanje plinova. Filtrirani zrak prolazi kroz membranski modul. Protok prolazi kroz hiljade selektivnih vlakana. Azot izlazi iz zadnje strane membrane, a kiseonik kroz njene zidove.
Proizvodnja dušika zahtijeva kvalificiranu ugradnju cjelokupnog kompleksa opreme, što zahtijeva usklađenost sa sigurnosnim standardima.
Oprema za proizvodnju dušika, koju proizvodi General Gas, uključuje komponente certificiranih proizvođača i testirana je kako bi se osigurala usklađenost sa visokim standardima kvalitete i sigurnosti industrijskih jedinica.
Ova oprema vam omogućava da postignete visoku energetsku efikasnost u proizvodnji azota, koji se koristi u različitim industrijama:
- elektronski;
- hrana;
- obrada metala;
- farmaceutski;
- metalurški;
- nafta i gas;
- petrohemijske i hemijske.
Kupovinom opreme za proizvodnju azota od naše kompanije dobijate povoljne cene, garanciju, brzu isporuku i montažu.
Kako odabrati opremu za proizvodnju dušika?
Da biste odabrali vrstu jedinice za odvajanje zraka, morate razumjeti šta su:
Za dobijanje tehničkih gasova iz atmosferskog vazduha trenutno postoje tri tipa jedinica za odvajanje vazduha (ASU):
- Jedinice za odvajanje vazduha kriogenog tipa.
- Jedinice za odvajanje vazduha adsorpcionog tipa.
- Membranske jedinice za odvajanje vazduha.
ASU kriogenog tipa je kompleks opreme koja vrši sekvencijalnu obradu i hlađenje atmosferskog zraka do kriogenih temperatura i naknadno razdvajanje rektifikacijama na njegove komponente: kisik, dušik, argon, kripton, ksenon.
Kriogeni ASU se dijele na:
- Mala = 30 ÷ 300 m³/sat;
- Prosjek = 300 ÷ 3000 m³/sat;
- Visoka > 3000 m³/sat;
ASU adsorpcionog tipa je skup opreme koja odvaja atmosferski zrak propuštanjem kroz molekularno sito, koje svojom strukturom može zadržati molekule plina. Adsorpcioni ASU su dizajnirani da dobiju glavne proizvode separacije u gasovitom stanju:
- Kiseonik;
- Azot.
Produktivnost adsorpcionih jedinica nije ograničena i zavisi od broja modula koji se koriste, ali postoje ograničenja u koncentraciji (čistoći) proizvoda separacije:
- Izlazna koncentracija gasa kiseonika do 98%
- Izlazna koncentracija azotnog gasa do 99,9995%
Membranski ASU su skup opreme koja odvaja komprimirani zrak propuštanjem kroz membranske module, u kojima se razdvaja na svoje glavne komponente: dušik i kisik. Membranski ASU su dizajnirani da dobiju proizvode separacije u gasovitom stanju. Učinak membranskih instalacija ovisi o broju korištenih membranskih modula.
- Koncentracija gasovitog kiseonika na izlazu je do 90%.
- Koncentracija gasovitog azota na izlazu je do 99,5%.
Takođe, za dobijanje gasovitih gasova na mestu potrošnje koriste se kriogeni gasifikatori, koji zauzvrat pretvaraju tečni krio-proizvod (azot, kiseonik ili argon) u gasovito stanje.
U kom slučaju, koji ASU treba koristiti za dobijanje AZOTA?
Da biste odabrali ASU morate znati sljedeće parametre:
- Potrošnja dušika m³/sat;
- Pritisak azota, bar;
- Koncentracija dušika, % ili frakcija preostalog kisika;
- Vrhunska potrošnja, broj „vrhova“, trajanje i učestalost;
- Mogućnost postavljanja ugradnje (na otvorenom, u zatvorenom...);
- Postojeće komunikacije;
- Udaljenost od objekta;
- Raspored rada (potrošnja);
- Dostupnost osoblja.
Pogledajmo vizuelni grafikon:
na grafikonu:
- Isporuka u cilindrima
- Isporuka tečnost ili u cilindrima
- Isporuka u tečnom stanju
- Kriogene ASU
Odabir izvora azota je složen i zahtjevan zadatak. Efikasnost proizvodnih procesa i cijena finalnog proizvoda zavise od pravilnog izbora.
U ovom trenutku tržište adsorpcionih azotnih generatora se ubrzano razvija i u područjima gdje je potreban plinoviti dušik, ovaj tip generatora pokazuje najnižu cijenu proizvodnje dušika, koja iznosi ~0,3 kW po 1 metru kubnog dušika.
Korištena tehnologija
Generator izvlači dušik iz okolnog zraka i drugih plinova koristeći tehnologiju adsorpcije s promjenama tlaka. Tokom procesa adsorpcije sa promenljivim pritiskom, komprimovani čisti ambijentalni vazduh se uvodi u molekularno sito, koje omogućava da azot prođe kao gas proizvoda, ali adsorbuje druge gasove. Zaslon omogućava adsorbiranim plinovima da pobjegnu u atmosferu kada je izlazni ventil zatvoren i tlak filtracije se vraća na tlak okoline. Filterski sloj se zatim pročišćava dušikom prije nego što se uvede svježi komprimirani zrak za novi proizvodni ciklus. Kako bi se osigurao konstantan protok proizvoda, generatori dušika koriste dva sloja molekularnog filtera koji su naizmenično povezani između faze adsorpcije i faze regeneracije. U normalnim radnim uslovima i uz pravilno održavanje, slojevi molekularnog filtera imaju skoro neograničen radni vek. Tehnologija adsorpcije sa kolebanjem pritiska ima nekoliko međunarodnih patenata i zadovoljava tržišne standarde u pogledu performansi i efikasnosti.
Raspored opreme
Da bi generator dušika radio automatski, potrebne su sljedeće komponente:
Dovod komprimovanog vazduha
Isporuka određene količine komprimiranog zraka i određenog kvaliteta, opisanog u dijelu ponude. Minimalna količina slobodnog dovoda komprimiranog zraka u m 3 /min na 20°C jednaka je prosječnoj potrošnji zraka generatora dušika u Nm 3 /min, uvećanoj za odgovarajući postotak kako bi se kompenzirao utjecaj ambijentalnog zraka i dizajn tolerancije zračnog kompresora u projektnim uvjetima. Sistem kompresije vazduha biće uključen u obim isporuke, koji će se sastojati od vazdušnog kompresora i rashladnog sušača vazduha.
Filteri za zrak
Komplet grubih filtera i filtera visoke čistoće i filter sa aktivnim ugljem uvek su uključeni u obim isporuke. Filteri za zrak moraju se postaviti između sistema komprimovanog zraka i prijemnika zraka kako bi se osiguralo da će generator dušika primiti potrebnu minimalnu količinu dušika.
Prijemnik zraka
Prijemnik zraka je ugrađen između filtera zraka i generatora dušika. Glavni zadatak prijemnika zraka je da u kratkom vremenskom periodu osigura dovod dovoljne količine svježeg zraka u novoobnovljeni filterski sloj generatora dušika. Ako je sistem komprimovanog vazduha uključen u opseg isporuke, dimenzije zapremine prijemnika vazduha će varirati do onih koje su zadovoljavajuće za proces i kompresiju vazduha (maksimalni ciklusi opterećenja/praznog hoda).
Prijemnik azota
Protok proizvoda generatora azota se sakuplja u jednom prijemniku azota. Prijemnik dušika mora biti instaliran u neposrednoj blizini generatora dušika. Prisustvo prijemnika azota garantuje dovoljan povratni pritisak za proces i konstantan protok azota do krajnjeg kupca. Osim ako nije izričito navedeno, zapremina prijemnika azota se izračunava na osnovu pretpostavke konstantne dinamike potrošnje od strane aplikacije Kupca u dužem vremenskom periodu.
Prednosti:
Sigurnost
Niski radni pritisci, sigurno skladištenje. Nema potrebe za teškim plinskim bocama visokog pritiska. Opasno skladištenje tečnog azota može se eliminisati.
Ekonomija
Nema troškova distribucije ili obrade. Proizvodnja dušika na licu mjesta (industrijska lokacija) pomoću generatora dušika štedi troškove obrade i skladištenja u plinskim bocama pod visokim pritiskom i sprječava gubitke kod iznajmljivanja, transporta i isparavanja za korisnike.
Niski operativni troškovi.
Predloženi proces ima efikasnije odvajanje od drugih sistema na tržištu. Ovo smanjuje potrebu za dovodom vazduha, što rezultira uštedom energije od 10 - 25% u poređenju sa uporedivim sistemima. Održavanjem rotirajućih dijelova na minimumu i korištenjem komponenti visokog kvaliteta, troškovi održavanja ostaju niski tokom cijelog vijeka trajanja generatora.
Pogodnost
Jednostavan za instalaciju i održavanje. Generatori azota imaju ulaz i izlaz azota na istoj strani. To znači jednostavnu instalaciju, čak i pod malim uglovima u radionici. Visoka pouzdanost zbog smanjenog broja rotirajućih dijelova i visokokvalitetnih komponenti.
Zagarantovan kvalitet azota
Nema rizika od nedovoljne čistoće dušika, automatski nastavak procesa. Generatori azota imaju jedinstven kontrolni sistem: ako čistoća azota ne odgovara navedenoj vrednosti, PLC automatski zatvara tok proizvodnje azota do izlaza iz aplikacije korisnika i otvara ventil za otpuštanje azota van specifikacije. Sustav će pokušati pokrenuti proces, a kada čistoća dušika dostigne željeni rezultat, prelivni ventil će se zatvoriti i ventil za unos dušika će se ponovo otvoriti. Potpuno automatska procedura bez nadzora, nije potrebno ručno ponovno pokretanje.
Uslovi projektovanja
| Performanse | 1000 Nm³/h (2 x 500 Nm³/h) |
| Preostali sadržaj kiseonika i proizvedeni gas | £0,1% vol. |
| Pritisak dovoda proizvoda | 5,5 barg |
| Tačka rose proizvoda | £-40 °C na 1 atm. |
| Ulazni protok vazduha | 4392,0 Nm³/h (2 x 2196,0 Nm³/h) |
| Max. nivo buke | 85 dB(A) na 1 metar |
| Planirani uslovi životne sredine | |
| Barometarski pritisak | 1013,25 mbar a |
| Visina lokacije | 0 m nadmorske visine |
| Temperatura vazduha | 20 °C |
| Relativna vlažnost | 65% |
| Potrošnja ulaznog vazduha | |
| Pritisak | |
| Temperatura | |
| Grupni sastav ugljovodonika | <6,25 мг/м³ или 5 ppmV |
| Čestice | <5 мг/м³ при макс. 3 мкм |
| Tačka rose | £+3 °C na 7 bara. |
| Uslovi lokacije | |
| Sistem napajanja | 400 / 230 V AC, 50 Hz |
| Klasifikacija zona | neklasifikovano područje/sigurno područje |
| smještaj | u prostoriji sa dobrom ventilacijom |
Podaci dati za idealne radne uslove, tolerancija ±5%

Dimenzije, težina
Energetske postavke
Tolerancija na sve navedene vrijednosti: ± 10%
Obim isporuke
4 vazdušna kompresora
- Vijčani kompresor za ubrizgavanje ulja
4 sušača zraka
- rashladni sušač zraka
2 prijemnika zraka
- vertikalna posuda pod pritiskom od ugljeničnog čelika
- zapremina: 3000 l
filteri komprimovanog vazduha
Dva seta eksternih filtera komprimovanog vazduha su postavljena ispred prijemnika vazduha, set se sastoji od sledećih filtera:
- jedan koalescentni filter za primarno prečišćavanje (efikasnost 99,9999%, 1,0 µ - ≤ 0,5 mg/m³) sa uređajem za odvod kondenzata sa plovkom;
- jedan koalescentni fini filter (efikasnost 99,9999%, 0,01 µ - ≤ 0,1 mg/m³) sa uređajem za odvod kondenzata sa plovkom;
- jedan filter sa aktivnim ugljem (zaostalo ulje ≤ 0,005 mg/m³).
dva generatora azota
Dva generatora dušika, potpuno prethodno ožičena, montirana na okvir od obojenog ugljičnog čelika, svaki opremljen sljedećim komponentama:
- 6 adsorpcijskih tornjeva, od kojih je svaki ispunjen ugljeničnim molekularnim sitom. Ugljično molekularno sito će se proizvoditi u SAD-u, Evropi ili Japanu. Sita proizvedena u Kini ili Indiji se ne koriste;
- Prigušivač izduvnih gasova, instaliran da priguši izduvni gas do projektovanog nivoa buke;
- Set elektropneumatskih procesnih ventila i prigušnica, uklj. solenoidni ventili;
- 1 podstandardna linija za pročišćavanje azota sa elektromagnetnim kontrolnim ventilom;
- Set sigurnosnih ventila podešenih na odgovarajući nivo pritiska;
- Svi cjevovodi i električni kablovi za priključke;
- Lokalni senzori tlaka;
- Jedan (1) kontrolni sistem za potpuno automatski rad generatora, potpuno interno ožičen i koji se sastoji od sljedećih stavki:
- Jedan PLC (Rockwell/Allen Bradley Micro 850 PLC) sa Ethernet/IP vezom za komunikaciju sa korisnikovim sistemom daljinskog upravljanja;
- Jedan grafički korisnički interfejs sa ekranom osetljivim na dodir (Rockwell/Allen Bradley C400) koji prikazuje vrednosti relevantnih parametara u realnom vremenu i moguće alarmne poruke za direktnu dijagnostiku;
- Svi cjevovodi, ventili, instrumentacija i kontrolni sistem po principu ključ u ruke montirani na okvir od ugljičnog čelika;
- Jedan (1) samostalni analizator rezidualnog azota sa senzorom od cirkonijuma;
- Jedan samostalni elektronski mjerač protoka proizvoda.
dva (2) prijemnika azota
- vertikalna posuda visokog pritiska od ugljeničnog čelika;
- sigurnosni ventili postavljeni na odgovarajući nivo pritiska
- zapremina: 3000 l
- maks. radni pritisak: 11,0 barg
Primjenjivi standardi
- Direktiva 2009/105/EC za jednostavne posude pod pritiskom
- Evropska direktiva 97/23/EC, EN 13445, EN 13480 o opremi pod pritiskom
- Direktiva 2004/108/EC o elektromagnetnoj kompatibilnosti
- Direktiva EU 2006/95/EC o niskonaponskoj električnoj opremi
- Direktiva o mašinama 2006/42/EC
Napomena
S obzirom na potrebne performanse, modularni dizajn nije moguć.
Amonijak (NH 3) je spoj dušika i vodonika. To je lagani plin oštrog mirisa. Proizvodnja amonijaka u industriji i laboratorijama neophodna je za proizvodnju đubriva, polimera, azotne kiseline i drugih supstanci.
U industriji
Amonijak se industrijski proizvodi iz dušika kombiniranjem s vodikom. Azot se uzima iz vazduha, vodonik iz vode. Metodu je prvi razvio njemački hemičar Fritz Haber. Industrijska metoda za proizvodnju amonijaka počela se nazivati Haberovim procesom.
Reakcija se događa smanjenjem volumena i oslobađanjem energije u obliku topline:
3H 2 + N 2 → 2NH 3 + Q.
Reakcija je reverzibilna, tako da mora biti ispunjeno nekoliko uslova. Pri visokom pritisku i niskim temperaturama povećava se volumen proizvedenog amonijaka. Međutim, niske temperature usporavaju brzinu reakcije, a povećanje temperature povećava brzinu obrnute reakcije.
Eksperimentalno su pronađeni neophodni uslovi za izvođenje reakcije:
- temperaturu- 500°C;
- pritisak- 350 atm;
- katalizator- oksid gvožđa Fe 3 O 4 (magnetit) sa primesama oksida srebra, kalijuma, kalcijuma i drugih materija.
Pod ovim uslovima, nastali gas sadrži 30% amonijaka. Da bi se izbjegla obrnuta reakcija, tvar se brzo hladi. Na niskim temperaturama nastali plin se pretvara u tekućinu. Neiskorišćeni gasovi - azot i vodonik - vraćaju se nazad u kolonu za sintezu. Ova metoda pomaže da se brzo dobiju velike količine amonijaka, koristeći što je više moguće sirovine.

Rice. 1. Industrijska proizvodnja amonijaka.
Da bi se pronašao pravi katalizator, isprobano je 20 hiljada različitih supstanci.
U laboratoriji
Za dobivanje amonijaka u laboratoriju koristi se reakcija alkalija s amonijevim solima:
NH 4 Cl + NaOH → NH 3 + NaCl + H 2 O
Amonijak se također može dobiti u laboratoriji iz amonijevog hlorida zagrijanog zajedno sa gašenim vapnom, ili razgradnjom amonijum hidroksida:
- 2NH 4 Cl + Ca(OH) 2 → CaCl 2 + 2NH 3 + 2H 2 O;
- NH 4 OH ↔ NH 3 + H 2 O.

Rice. 2. Dobivanje amonijaka u laboratoriji.
Amonijak se može potpuno osušiti mješavinom vapna i natrijevog hidroksida, kroz koju se propušta nastali plin. U istu svrhu, tekući amonijak se miješa s metalnim natrijem i podvrgava destilaciji.
Amonijak je lakši od zraka, tako da se epruveta drži naopako da bi se prikupio.
Aplikacija
Amonijak se koristi u raznim industrijama:
- u poljoprivredi - za proizvodnju đubriva koja sadrže dušik;
- u industriji - za proizvodnju polimera, eksploziva, vještačkog leda;
- u hemiji - za proizvodnju dušične kiseline, sode;
- u medicini - kao amonijak.

Rice. 3. Proizvodnja gnojiva.
Šta smo naučili?
Amonijak se proizvodi industrijski i laboratorijski. Za proizvodnju u industrijskim razmjerima koriste se dušik i vodik. Miješanjem pod visokom temperaturom, pritiskom i pod utjecajem katalizatora, jednostavne tvari formiraju amonijak. Kako bi se spriječilo da reakcija ide u suprotnom smjeru na visokim temperaturama, plin se hladi. U laboratoriji, amonijak se dobija reakcijom amonijevih soli sa alkalijama, gašenim vapnom ili razlaganjem amonijum hidroksida. Amonijak se koristi u hemijskoj industriji, poljoprivredi, medicini i hemiji.
Azot je hemijski element koji je svima poznat. Označava se slovom N. Može se reći da je osnova neorganske hemije, te se stoga počinje izučavati u osmom razredu. U ovom članku ćemo detaljnije pogledati dušik, kao i njegove karakteristike i svojstva.
Istorija otkrića elemenata
Jedinjenja kao što su amonijak, nitrat i dušična kiselina bila su poznata i korištena u praksi mnogo prije nego što je čisti dušik dobijen u slobodnom stanju.

U eksperimentu provedenom 1772., Daniel Rutherford je spalio fosfor i druge tvari u staklenom zvonu. Otkrio je da plin koji ostaje nakon sagorijevanja jedinjenja ne podržava sagorijevanje i disanje, te ga je nazvao "zrak za gušenje".
Godine 1787. Antoine Lavoisier je ustanovio da su plinovi koji čine običan zrak jednostavni hemijski elementi i predložio je naziv "Azot". Nešto kasnije (1784.) fizičar Henry Cavendish je dokazao da je ova tvar dio nitrata (grupa nitrata). Odatle potiče latinski naziv za dušik (od kasnolatinskog nitrum i grčkog gennao), koji je predložio J. A. Chaptal 1790. godine.
Do početka 19. vijeka naučnici su razjasnili hemijsku inertnost elementa u slobodnom stanju i njegovu izuzetnu ulogu u jedinjenjima sa drugim supstancama. Od tog trenutka, „vezivanje“ azota iz vazduha postalo je najvažniji tehnički problem u hemiji.
Fizička svojstva

Azot je nešto lakši od vazduha. Gustina mu je 1,2506 kg/m³ (0 °C, 760 mm Hg), tačka topljenja -209,86 °C, tačka ključanja -195,8 °C. Azot se teško rastvara u tečnost. Njegova kritična temperatura je relativno niska (-147,1 °C), dok je kritični pritisak prilično visok - 3,39 Mn/m². Gustina u tečnom stanju - 808 kg/m³. Ovaj element je manje rastvorljiv u vodi od kiseonika: u 1 m³ (na 0 °C) H₂O može rastvoriti 23,3 g N. Ova brojka je veća kada se radi sa nekim ugljovodonicima.
Kada se zagrije na niske temperature, ovaj element stupa u interakciju samo s aktivnim metalima. Na primjer, sa litijumom, kalcijumom, magnezijumom. Azot reaguje sa većinom drugih supstanci u prisustvu katalizatora i/ili na visokim temperaturama.
Jedinjenja N sa O₂ (kiseonikom) N₂O₅, NO, N2O₃, N2O, NO₂ su dobro proučavana. Iz njih, tokom interakcije elemenata (t - 4000 ° C), nastaje NO oksid. Nadalje, tokom procesa hlađenja, oksidira se u NO₂. Oksidi dušika nastaju u zraku tokom prolaska atmosferskih pražnjenja. Mogu se dobiti djelovanjem jonizujućeg zračenja na mješavinu N i O₂.

Kada se N₂O₃ i N2O₅ rastvore u vodi, dobijaju se kiseline HNO₂ i HNO₂, formirajući soli - nitrate i nitrite. Dušik se kombinuje sa vodonikom isključivo u prisustvu katalizatora i na visokim temperaturama, formirajući NH₃ (amonijak). Osim toga, poznata su i druga (prilično su brojna) jedinjenja N sa H₂, na primjer diimid HN = NH, hidrazin H₂N-NH₂, oktazon N₈H₁₄, kiselina HN₃ i drugi.
Vrijedi reći da je većina spojeva vodika + dušika izolirana isključivo u obliku organskih derivata. Ovaj element ne reaguje (direktno) sa halogenima, pa se svi njegovi halogenidi dobijaju samo indirektno. Na primjer, NF₃ nastaje kada amonijak reagira s fluorom.
Većina azotnih halogenida su slabo stabilna jedinjenja: NOBr, NO₂F, NOF, NOCl, NO₂Cl; Direktna kombinacija N sa sumporom se takođe ne dešava tokom reakcije amonijak + tečni sumpor; Kada vrući koks reaguje sa N, nastaje cijanogen (CN)₂. Zagrevanjem acetilena C₂H₂ sa azotom na 1500 °C, može se dobiti cijanovodonik HCN. Kada N stupi u interakciju s metalima na relativno visokim temperaturama, nastaju nitridi (na primjer, Mg₃N₂).
Kada je obični azot izložen električnim pražnjenjima [pritisku od 130–270 n/m² (što odgovara 1–2 mm Hg)] i tokom razgradnje Mg₃N₂, BN, TiNx i Ca₃N₂, kao i tokom električnih pražnjenja u zraka, može se formirati aktivni dušik, koji ima povećane energetske rezerve. On, za razliku od molekularnog, veoma energično reaguje sa vodonikom, sumpornim parama, kiseonikom, nekim metalima i fosforom.
Azot je dio dosta važnih organskih spojeva, uključujući aminokiseline, amine, nitro spojeve i druge.
Dobijanje azota
U laboratoriji, ovaj element se lako može dobiti zagrevanjem koncentrovanog rastvora amonijum nitrita (formula: NH₄NO₂ = N₂ + 2H₂O). Tehnička metoda za dobijanje N zasniva se na odvajanju prethodno ukapljenog vazduha, koji se naknadno podvrgava destilaciji.
Područje primjene

Glavni dio dobivenog slobodnog dušika koristi se u industrijskoj proizvodnji amonijaka, koji se zatim u prilično velikim količinama prerađuje u gnojiva, eksplozive itd.
Pored direktne sinteze NH₃ iz elemenata, koristi se cijanamidna metoda razvijena početkom prošlog stoljeća. Zasnovan je na činjenici da pri t = 1000 °C kalcijum karbid (nastao zagrijavanjem mješavine uglja i vapna u električnoj peći) reagira sa slobodnim dušikom (formula: CaC₂ + N₂ = CaCN₂ + C). Rezultirajući kalcijum cijanamid se pod utjecajem zagrijane vodene pare razlaže na CaCO₃ i 2NH₃.
U slobodnom obliku ovaj element se koristi u mnogim industrijama: kao inertni medij u raznim metalurškim i hemijskim procesima, pri pumpanju zapaljivih tečnosti, za popunjavanje prostora u živinim termometrima itd. U tečnom stanju koristi se u raznim rashladnim uređajima . Prevozi se i skladišti u čeličnim Dewar posudama, a komprimirani plin se skladišti u bocama.
Mnoga jedinjenja azota se takođe široko koriste. Njihova proizvodnja počela se ubrzano razvijati nakon Prvog svjetskog rata i sada je dostigla zaista ogromne razmjere.

Ova supstanca je jedan od glavnih biogenih elemenata i dio je najvažnijih elemenata živih stanica - nukleinskih kiselina i proteina. Međutim, količina dušika u živim organizmima je mala (otprilike 1-3% po suhoj težini). Molekularni materijal prisutan u atmosferi asimiliraju samo plavo-zelene alge i neki mikroorganizmi.
U tlu su koncentrisane prilično velike rezerve ove tvari u obliku raznih mineralnih (nitrati, amonijeve soli) i organskih spojeva (sastavljenih od nukleinskih kiselina, proteina i proizvoda njihovog razgradnje, uključujući još ne potpuno razgrađene ostatke flore i faune).
Biljke savršeno apsorbiraju dušik iz tla u obliku organskih i neorganskih spojeva. U prirodnim uslovima od velikog su značaja posebni zemljišni mikroorganizmi (amonifikatori) koji su sposobni mineralizovati organski N u amonijumove soli.
Nitratni azot u tlu nastaje tokom života nitrifikujućih bakterija, koje je otkrio S. Winogradsky 1890. godine. Oni oksidiraju amonijeve soli i amonijak u nitrate. Dio tvari koje asimiliraju flora i fauna gubi se djelovanjem denitrifikujućih bakterija.
Mikroorganizmi i biljke savršeno apsorbuju i nitrate i amonijum N. Aktivno pretvaraju neorganski materijal u različita organska jedinjenja – aminokiseline i amide (glutamin i asparagin). Potonji su dio mnogih proteina mikroorganizama, biljaka i životinja. Sintezu asparagina i glutamina amidacijom (enzimskom) asparaginske i glutaminske kiseline provode mnogi predstavnici flore i faune.
Proizvodnja aminokiselina odvija se reduktivnom aminacijom niza keto kiselina i aldehidnih kiselina, koja je rezultat enzimske transaminacije, kao i kao rezultat oksidacije različitih ugljikohidrata. Krajnji produkti asimilacije amonijaka (NH₃) od strane biljaka i mikroorganizama su proteini, koji su dio ćelijskog jezgra, protoplazme, a također se talože u obliku takozvanih skladišnih proteina.
Ljudi i većina životinja mogu sintetizirati aminokiseline samo u prilično ograničenoj mjeri. Nisu u stanju da proizvode osam esencijalnih jedinjenja (lizin, valin, fenilalanin, triptofan, izoleucin, leucin, metionin, treonin), pa su im glavni izvor azota proteini koji se unose hranom, odnosno, u krajnjoj liniji, sopstveni proteini mikroorganizama. i biljke.