Smagie ūdens izotopi. Dzeramā ūdens un pārtikas vieglie un smagie izotopi. Ūdens izotopologu fizikālās īpašības
Izotopologi ir molekulas, kas atšķiras tikai ar to atomu izotopu sastāvu, no kuriem tie sastāv. Izotopologs sastāv no vismaz viena noteikta ķīmiskā elementa atoma, kas neitronu skaita ziņā atšķiras no pārējiem.
Ūdens molekula sastāv no diviem ūdeņraža atomiem un viena skābekļa atoma.
Ūdeņradim ir divi stabili izotopi - protijs (H) - 1 H un deitērijs (D) - 2 H.
Skābeklim ir trīs stabili izotopi: 16 O, 17 O un 18 O (1. tabula).
1. tabula. Ūdens izotopi
5 stabilu ūdeņraža un skābekļa izotopu kombinācijas dod 9 ūdens izotopologu molekulu kopu (2. tabula).
2. tabula. Ūdens izotopologi
1 H 2 16 O molekula ir vieglākā no visiem ūdens izotopologiem. Tas ir ūdens 1 H 2 16 O, kas būtu jāuzskata par klasisko jeb vieglo ūdeni.
Vieglais ūdens kā monoizotopu sastāvs 1 H 2 16 O ir izotopu tīrības ierobežojošais gadījums. Dabiskos apstākļos tik tīrs viegls ūdens nepastāv. Lai iegūtu izotopologu 1 H 2 16 O, tiek veikta smalka daudzpakāpju dabisko ūdeņu attīrīšana vai sintezēta no sākotnējiem elementiem 1 H 2 un 16 O 2 . Dabīgais ūdens ir daudzkomponentu izotopologu maisījums. Vieglākā izotopologa saturs tajā ievērojami pārsniedz visu pārējo koncentrāciju kopā. Dabiskajos ūdeņos 1 000 000 molekulas satur vidēji 997 284 1 H 2 16 O molekulas, 311 1 HD 16 O molekulas, 390 1 H 2 17 O molekulas un aptuveni 2005 molekulas 1 1 O koncentrācijā. ūdens molekulu, kas satur smagos izotopus D , 17 O, 18 O, dabiskajā ūdenī svārstās robežās, kas noteiktas galvenajos hidrosfēras SMOW un SLAP izotopu sastāva standartos (3. tabula). Izotopologu masas daudzumi dabiskajā ūdenī aprēķināti, pamatojoties uz to satura tiešas noteikšanas ar molekulārās spektroskopijas datiem.
3. tabula. Aprēķinātie izotopologu masas daudzumi dabiskajā ūdenī atbilstoši starptautiskajiem standartiem SMOW (vidējā molekulmasa = 18,01528873) un SLAP (vidējā molekulmasa = 18,01491202), .
| Ūdens izotopologs | Molekulārā masa | Saturs, g/kg | |
|---|---|---|---|
| SMOW | SLAP | ||
| 1 H 2 16 O | 18,01056470 | 997,032536356 | 997,317982662 |
| 1 HD 16 O | 19,01684144 | 0,328000097 | 0,187668379 |
| D216O | 20,02311819 | 0,000026900 | 0,000008804 |
| 1 H 2 17 O | 19,01478127 | 0,411509070 | 0,388988825 |
| 1 HD 17 O | 20,02105801 | 0,000134998 | 0,000072993 |
| D217O | 21,02733476 | 0,000000011 | 0,000000003 |
| 1 H 2 18 O | 20,01481037 | 2,227063738 | 2,104884332 |
| 1 HD 18O | 21,02108711 | 0,000728769 | 0,000393984 |
| D218O | 22,02736386 | 0,000000059 | 0,000000018 |
Kā redzams 3. tabulā, dabīgā ūdenī smago izotopologu masas koncentrācija var sasniegt 2,97 g/kg, kas ir ievērojama vērtība, salīdzināma, piemēram, ar minerālsāļu saturu.
Dabīgais ūdens, kas pēc izotopologa 1 H 2 16 O satura ir tuvs SLAP standartam, kā arī īpaši attīrīts ar ievērojami lielāku šī izotopologa īpatsvaru salīdzinājumā ar SLAP standartu, tiek definēts kā īpaši tīrs vieglais ūdens (mazāk stingrs). definīcija, kas ir piemērojama reālajā dzīvē).
Vieglajā ūdenī vieglākā izotopologa īpatsvars ir (mol.%): 99,76< 1 H 2 16 O ≤ 100.
Ja no ūdens, kas atbilst SMOW standartam, izņemsim visas smagās molekulas ar masas saturu 2,97 g/kg un aizvietosim ar 1 H 2 16 O, tad šāda viegla un izotopi tīra ūdens 1 litra masa samazināsies par 250 mg. . Tādējādi vieglā ūdens parametrus, pirmkārt, tā "vieglumu" un izotopu sastāvu var izmērīt, izmantojot tādas metodes kā masas spektrometrija, gravimetrija, lāzerabsorbcijas spektroskopija, KMR.
Starptautiskie standarti dažāda izotopu sastāva dabiskajiem ūdeņiem
- Standarta VSMOW(Vienna Standard Mean Ocean Water) nosaka okeānu dziļūdens izotopu sastāvu.
- Standarta SLAP(Standarta gaismas Antarktikas nokrišņi) nosaka Antarktikas dabiskā ūdens izotopu sastāvu.
Saskaņā ar VSMOW starptautisko standartu deitērija un skābekļa-18 absolūtais saturs okeāna ūdenī ir: D VSMOW / 1 H VSMOW=(155,76±0,05) 10 -6 vai 155,76 ppm 18 O VSMOW/ 16 O VSMOW = (2005.20). ±0,45) 10–6 jeb 2005 ppm. SLAP standartam koncentrācijas ūdenī ir šādas: deitērijs D/H=89 10 -6 vai 89 ppm, skābeklis-18 18 O/ 16 O = 1894 10 -6 vai 1894 ppm.
SLAP standarts raksturo vieglāko dabisko ūdeni uz Zemes. Ūdens dažādās pasaules malās savā vieglumā nav vienāds.
Vieglā ūdens īpašības un iedarbība
Izotopologi atšķiras viens no otra pēc fizikālajām, ķīmiskajām un bioloģiskajām īpašībām (4. tabula).
4. tabula. Ūdens fizikālo īpašību izmaiņas izotopu aizvietošanas laikā
Ūdens izotopologu līdzsvara tvaika spiediens atšķiras, turklāt diezgan būtiski. Jo mazāka ir ūdens molekulas masa, jo lielāks ir tvaika spiediens, kas nozīmē, ka tvaiki, kas ir līdzsvarā ar ūdeni, vienmēr ir bagātināti ar skābekļa un ūdeņraža gaismas izotopiem. Attiecībā uz mazo elementu masu izotopu masu atšķirība ir liela, tāpēc tie spēj spēcīgi frakcionēt dabiskos procesos: D/H → 100%, 18 O/ 16 O → 12,5%. Ūdeņraža un skābekļa izotopus visefektīvāk frakcionē ūdens iztvaikošanas-kondensācijas un kristalizācijas procesos.
Eksperimentālo pētījumu rezultāti liecina par atšķirību fizikālās un ķīmiskās īpašības vieglais ūdens un dejonizēts dabīgā izotopu sastāva ūdens.
Smagie izotopologi dabiskajā ūdenī ir piemaisījumi attiecībā pret 1 H 2 16 O, ko saskaņā ar dažiem pētījumiem var uzskatīt par strukturāliem defektiem.
Ūdens neviendabīguma novēršana izotopu sastāva ziņā palielina tā viendabīgumu. Viegls ūdens ir viendabīgāks šķidrums. Smagās izotopu molekulas, kas atrodas ūdenī dabiskā koncentrācijā, praktiski neietekmē nedzīvas sistēmas. Vislielākā mērā vieglā ūdens ietekme izpaužas bioloģiskos objektos, kam raksturīgas kaskādes reakcijas.
Biosistēmu reakcija, saskaroties ar ūdeni, var mainīties atkarībā no tā izotopu sastāva kvantitatīvajām un kvalitatīvajām izmaiņām. Dzīvo organismu evolūcijas gaitā notika bioķīmisko procesu atlase ar to noskaņošanu tikai uz vienu izotopu, parasti gaismas. Cilvēka ķermenī “notiek izotopu frakcionēšana, ko papildina smago stabilo ūdeņraža un skābekļa izotopu izvadīšana no ūdens”. Ūdens ar paaugstinātu smago izotopu, īpaši deitērija, koncentrāciju lietošana izraisa izteiktu toksisku iedarbību organisma līmenī. Tajā pašā laikā dažādās vietās tika reģistrēta pozitīva bioloģiskā aktivitāte ūdeņiem ar mazāku (salīdzinājumā ar dabisko) smago izotopologu, īpaši deitērija un skābekļa 18, saturu. Krievijas Zinātņu akadēmijas Valsts pētniecības centrā "Biomedicīnas problēmu institūtā" veiktie sistemātiski pētījumi par biotopa izveidi astronautiem ar optimālu biogēno ķīmisko elementu izotopu sastāvu ir parādījuši, ka ūdens ar samazinātu smago izotopu saturu. molekulas, salīdzinot ar smago izotopu molekulu dabisko saturu, ir nepieciešama astronautu dzīvības uzturēšanas sistēmas sastāvdaļa ilgstošu lidojumu laikā.
Bioloģiskās īpašības
Kā universāla vide, kurā notiek visas bioloģiskās reakcijas, vieglais ūdens palielina šo reakciju ātrumu salīdzinājumā ar dabīgā izotopu sastāva ūdeni. Šo efektu sauc par šķīdinātāja kinētisko izotopu efektu.
Transports gaismas īpašībasūdeņi ir pierādīti pētījumos par smago izotopologu ietekmi dabiskā ūdens sastāvā uz krāsvielas metilēnzilā izdalīšanās dinamiku no spīļo varžu ožas sistēmas.
Ūdens attīrīšana no smagajiem izotopologiem visspēcīgāk ietekmē dzīvas šūnas enerģijas aparātu. Mitohondriju elpošanas ķēde atšķiras ar kaskādes reakcijām. Smagie izotopologi palēnina elpošanas ķēdes reakciju ātrumu. Ūdeņraža peroksīda veidošanās reakcijas piemērā mitohondrijās ar dzintarskābe Kā substrāts ir eksperimentāli pierādīta ūdens smago izotopologu vispārējā inhibējošā iedarbība. To satura samazināšana ūdenī līdz līmenim, kas zemāks par dabisko koncentrāciju, dehibē un ievērojami paātrina pētīto reakciju.
Vieglajam ūdenim ir pretvēža aktivitāte, kas parādīta zinātnieku darbā pētniecības centros dažādas valstis. Pēc G. Šomlai teiktā, klīnisko pētījumu rezultāti, kas veikti 1994.-2001. Ungārijā parādīja, ka izdzīvošanas rādītājs pacientiem, kuri lietoja vieglu ūdeni kombinācijā ar tradicionālajām ārstēšanas metodēm vai pēc tām, ir augstāks nekā pacientiem, kuri izmantoja tikai ķīmijterapiju vai staru terapiju.
Vieglā ūdens toksikoprotektīvās īpašības apstiprina eksperimentāli pētījumi, no kuriem izriet, ka vieglais ūdens, attīrīts no smagajiem izotopologiem, savu transportēšanas īpašību dēļ efektīvi izvada no organisma toksīnus un vielmaiņas produktus.
Skatīt arī
Piezīmes
- Kulsky L. A., Dal V. V., Lenchina L. Ūdens ir pazīstams un noslēpumains. - Kijeva: "Radjanskas skola", 1982.- 120 lpp.
- Petrjanovs-Sokolovs IV Visneparastākā viela pasaulē.// Ķīmija un dzīve. 2007. Nr.1. 26.lpp.
- Rothman et al., J. Quant. Spectrosc. Radiācija. Transfer, 1998, 60, 665. Rothman et al., J. Quant. Spectrosc. Radiācija. Pārskaitījums, 2003, 82, 9. lpp.
- Patents RU 2295493. "Vieglā ūdens ražošanas metode un uzstādīšana." Solovjovs S.P.
- Lis G., Wassenaar L. I., Hendry M. J. High-Precision Laser Spectroscopy D/H and 18 O/ 16 O Measurements of Microliter Natural Water Samples.// Anal. Chem. 2008. V. 80 (1). 287.-293. lpp
- Ferronskis V. I., Poļakovs V. A. Hidrosfēras izotopija. M.: Nauka, 1983. gads
- Kreigs, H. Deitērija un skābekļa-18 koncentrācijas ziņošanas standarts dabiskajos ūdeņos. // Zinātne. 1961. V. 133. PP. 1833-1834.
- Hagemann R., Niff G., Roth E. Absolūtā izotopu skala dabisko ūdeņu deitērija analīzei. Absolūtā D/H attiecība SMOW. // Pastāsti mums. 1970.V.22. N6. PP.712-715.
- De Wit J.C., van der Straaten C.M.; Mook W.G. VSMOW un SLAP absolūtās ūdeņraža izotopu attiecības noteikšana. // Ģeostandartu biļetens. 1980. V. 4. N. 1. PP. 33-36.
- V.V. Gončaruks, V.B. Lapšins, T.N. Burdeinaja, T.V. Pleteņeva, A.S. Černopjatko et al. Smago izotopu noplicinātā ūdens fizikāli ķīmiskās īpašības un bioloģiskā aktivitāte // 2011, publicēts Khimiya i Tekhnologiya Vody, 2011, Vol. 33, Nr. 1, lpp. 15.–25. Journal of Water Chemistry and Technology, 2011, Vol. 33, Nr. 1, lpp. 8.–13.
- Smirnovs A. N., Lapšins V. B., Bališevs A. V., Ļebedevs I. M., Gončaruks V. V., Siroeškins A. V. Ūdens struktūra: milzu heterofāzes ūdens kopas. // Ūdens ķīmija un tehnoloģija. - 2005.- Nr.2. - C. 11-37; Smirnovs A. N., Siroeškins A. V. Ūdens supranadmolekulārie kompleksi. // Ros. chem. un. - 2004.- T.48 - Nr. 2. - C. 125-135
- Sinyak Yu. E., Grigoriev AI Optimāls biogēno ķīmisko elementu izotopu sastāvs uz pilotējamiem kosmosa transportlīdzekļiem. // Aviācija un ekoloģiskā medicīna. 1996. V. 30, Nr. 4, S. 26.
- Sinjaks Ju.E., Skuratovs V.M., Gaidadimovs V.B., Ivanova S.M., Pokrovskis B.G. Grigorjevs A.I. Stabilo ūdeņraža un skābekļa izotopu frakcionēšanas izpēte Starptautiskajā kosmosa stacijā. // Aviācija un ekoloģiskā medicīna. 2005. V. 39, Nr. 6, S. 43.
- Denko EI Smagā ūdens (D2O) iedarbība uz dzīvnieku, augu un mikroorganismu šūnām. // Veiksmi. moderns Biol.. 1970. V. 70, Nr. 4, S. 41.
- Lobiševs VI D2O termodinamiskās un kinētiskās izotopu iedarbības mehānismi bioloģiskajās sistēmās Darba kopsavilkums. doc. disertācijas. Maskava, - 1987 (Maskavas Valsts universitātes Bioloģiskā fakultāte)
- GLEASON J.D., FRIEDMAN I. Auzas var labāk augt ūdenī, kurā trūkst skābekļa 18 un deitērija. NATURE 256, 305 (1975. gada 24. jūlijs)
- Bild W, Năstasă V, Haulică I. In vivo un in vitro pētījumi par deitērija noplicināta ūdens bioloģisko ietekmi: 1. Ar deitēriju noplicināta ūdens ietekme uz kultivēto šūnu augšanu. // Rom J. Fiziol. 2004. V.41. N 1-2. P:53-67.
- Sinjaks Y., Grigorjevs A., Gaidadimovs V., Gurieva T., Levinskis M., Pokrovskis B. Deitēriju nesaturošs ūdens (1H2O) kompleksās dzīvības uzturēšanas sistēmās ilgtermiņa kosmosa misijās. // Acta Astronautica. 2003. V. 52, 575. lpp.
- Reichardt, K. "Šķīdinātāji un ietekme uz vidi organiskajā ķīmijā." -M.: "Mir", 1991. - 763 lpp.
- T.N. Burdeinaja, V.A. Poplinskaja, A.S. Černopjatko, E.N. Grigorjans. Vieglā ūdens ietekme uz Xenopus laevis kāpuru ožas sistēmas krāsvielu atdalīšanas dinamiku // Ūdens: ķīmija un ekoloģija 2011.-№9 - P. 86-91
- Pomitkins I.A., Koļesova O.E. //Eksperimentālās bioloģijas un medicīnas biļetens. 2006. V.142. N 5.
- Gyöngyi Z, Somlyai G. Deitērija samazināšanās var samazināt C-myc Haras un p53 gēna ekspresiju ar kancerogēnu ārstētām pelēm. // In vivo. 2000. V.14. N.3. 437. lpp.
Ūdens molekulas atšķiras viena no otras pēc izotopu sastāva. Pašlaik ir zināmi 5 dažādi ūdeņraža izotopi. No tiem tikai divi ir stabili: vieglākais protijs - ar atomu masu 1, to apzīmē ar simbolu 1H - sastāv no 1 protona un 1 elektrona, un smagais ūdeņradis jeb deitērijs ar atomu masu 2, tas ir apzīmē ar simbolu 2D – sastāv no 1 protona, 1 neitrona un 1 elektrona. Trešais supersmagais ūdeņradis (ar atomu masu 3) attiecīgi sastāv no 1 protona, 2 neitroniem un 1 elektrona. Tritijs ir radioaktīvs, tā pussabrukšanas periods ir aptuveni 12,3 gadi. Citu izotopu kalpošanas laiks nepārsniedz dažas sekundes.
Skābeklim ir seši izotopi: O14, O15, O16, O17, O18 un O19. Trīs no tiem: O16, O17 un O18 ir stabili, un O14, O15 un O19 ir radioaktīvie izotopi. Stabili skābekļa izotopi ir sastopami visos dabiskajos ūdeņos: to attiecība ir šāda: uz 10 000 daļām O16 ir 4 daļas O17 un 20 daļas O18.
Ūdens izotopu jeb izotopu iedarbība balstās uz ūdeņraža un skābekļa izotopu īpašību atšķirībām to atšķirību dēļ atomu masas, inerces momenti, atbilstošo ķīmisko saišu stiprums. Izotopu masu relatīvā atšķirība ir jo mazāka, jo lielāks ir elementa atomu skaits. Ūdeņraža izotopiem tas ir 100% deitērijam D (2H) un 200% tritijam T (3H), salīdzinot ar protiju H (1H). Tāpēc ūdeņradim izotopu ietekme ir visizteiktākā.
Ir 42 ūdens izotopologi (dažādu izotopu atomu kombinācijas veido izotopologu molekulu kopu) (ieskaitot stabilus un nestabilus ūdeņraža un skābekļa izotopus). No tām trīsdesmit trīs ūdens molekulas ir radioaktīvas, un deviņas ir stabilas, stabilas ūdens molekulas.
Molekulu ar atšķirīgu izotopu sastāvu veidošanās varbūtība nav vienāda. Visizplatītākā ir molekula ar mazāko masu, kas sastāv no ūdeņraža - 1 (protium) un skābekļa - 16. Citu smagāku molekulu saturs dabā nepārsniedz 0,23%, ūdens izotopu modifikāciju saturs dabā uzrādīts Tabula. 1.
1. tabula
Uz att. 6. attēlā redzams, ka 2Н daudzums atmosfēras mitrumā un dabiskajos ūdeņos ir atkarīgs no klimata, reģiona tuvuma jūrām un ledājiem un augstuma virs okeāna līmeņa. Pasaules praksē ir ierasts deitērija saturu izteikt ‰ vai ppm. Ppm ir monodeuterēto skaits
ūdens molekulas uz 1 miljonu molekulu, kas satur tikai gaismas izotopu 1H. Ūdenim iztvaikojot no okeāna virsmas, deitērija saturs mainās par 20 ppm.
Rīsi. 6. Ūdeņraža frakcionēšana atmosfēras ūdens ciklā
Slēgtajās rezervuāros ir vairāk smagā ūdens, jo, salīdzinot ar parasto ūdeni, tas iztvaiko mazāk intensīvi. Tāpēc apgabalos ar karstu klimatu ir vairāk smagā ūdens.
Okeāna virsma ir bagātināta arī ar deitēriju pie ekvatora (155 ppm) un tropos, kur veicina biežie nokrišņi, kuru veidošanās laikā no tvaiku fāzes kondensējas ūdens, bet smagais ūdens kondensējas ātrāk nekā gaisma, tāpēc nokrišņi tiek bagātināti. ar smagu ūdeni.
Zemākais 2H saturs ūdens tvaikos virs Antarktikas ledus ir ≈ 90 ppm. Arī deitērija īpatsvars Grenlandes ledū ir neliels (126 ppm). Deitērija saturs dažādas izcelsmes dabiskajos ūdeņos ir parādīts tabulā. 2.
Ir vērts pievērst uzmanību faktam, ka deitērija saturs Irkutskas apgabala dabiskajos ūdeņos ir zemāks nekā Krievijas Eiropas daļā un Eiropā. Tādējādi Baikālā D/H ir 137,0 ppm, bet dažos minerālavotos - 132,0 ppm, savukārt D saturs līdzīgos avotos Eiropā ir vismaz 145-150 ppm. Tādi dati
var izmantot, lai identificētu minerālu avotu
un galda ūdens (2. tabula).
2. tabula
Pamatojoties uz izotopu sastāvu, izšķir vieglo, smago un pussmago ūdeni.
Ūdens ar tikai viegliem izotopiem dabā nav sastopams. Nulles ūdens sastāv no tīra vieglā ūdeņraža un atmosfēras skābekļa. Šis ūdens ir izvēlēts kā atsauce: tam ir ļoti nemainīgs sastāvs. Ar to ir ērti salīdzināt nezināma sastāva ūdeni: nosakot blīvuma starpību, ir viegli atrast deitērija saturu. Formāli protija ūdeni sauc par vieglo ūdeni. Par vieglā ūdens darba standartu tiek uzskatīts 1H216O, 1H217O un 1H218O sastāva ūdens šķirņu maisījums, kas ņemts tādā pašā attiecībā, kādā gaisā atrodas attiecīgie skābekļa izotopi.
Smagais ūdens ir ūdens, kurā protijs ir pilnībā aizstāts ar deitēriju un ir attēlots ar formulu D2O. Skābekļa izotopiskais sastāvs šajā ūdenī parasti atbilst atmosfēras skābekļa sastāvam. Smagā ūdens blīvums ir 1104 kg/m3. Smagais ūdens vārās augstākā temperatūrā un sasalst zemākā temperatūrā nekā vieglais ūdens.
Pussmags ir ūdens ar jauktām HDO molekulām. Tas ir jebkurā dabīgā ūdenī, bet tīrā veidā to iegūt nav iespējams, jo ūdenī vienmēr notiek izotopu apmaiņas reakcijas. Ūdeņraža izotopu atomi ir ļoti mobili un nepārtraukti pārvietojas no vienas molekulas uz otru. Nav grūti pagatavot ūdeni, kura vidējais sastāvs atbildīs pussmagā ūdens formulai. Bet apmaiņas reakcijas dēļ tas būs molekulu maisījums ar dažādu izotopu sastāvu H2O, HDO, D2O.
Papildus visiem uzskaitītajiem ūdeņiem joprojām ir smagais skābekļa ūdens ar skābekļa atomu masu 18.
Ūdens molekulu izotopiskām modifikācijām ir dažāda ietekme uz ūdens struktūru. Piemēram, ūdens virsmas slāņa sakārtotās struktūras pašorganizēšanās notiek tā stabilizēšanas rezultātā ar HDO molekulām, kurām ir augstāka asociācijas enerģija nekā H2O molekulām.
Jūsu uzmanībai piedāvājam izdevniecības "Dabas vēstures akadēmija" izdotos žurnālus
Divi rādītāji ir pelnījuši īpašu uzmanību: metastāžu aizkavēšanās un dzīvnieku svara zudums eksperimentu laikā. “Vieglā” ūdens izteiktā stimulējošā iedarbība uz dzīvnieku imūnsistēmu izraisīja metastāžu attīstības aizkavēšanos par 40%, salīdzinot ar kontroles grupu, un svara zudums dzīvniekiem, kuri dzēra “vieglu” ūdeni, bija uz pusi mazāks par. eksperimenta beigas.
Eksperimenta dzīvniekus pakļaujot γ-apstarojumam LD50 devā, tika konstatēts, ka to dzīvnieku izdzīvošanas rādītājs, kuri 15 dienas pirms apstarošanas patērēja “vieglu” ūdeni (30 ppm), bija 2,5 reizes augstāks nekā kontroles grupā (apstarošana). deva 850 R) , kas norāda uz "viegla" ūdens radioaizsardzības īpašībām. Tajā pašā laikā eksperimentālās grupas izdzīvojušajām pelēm leikocītu un eritrocītu skaits asinīs saglabājās normas robežās, savukārt kontroles grupā būtiski samazinājās.
Tika atzīmēta arī nepārprotama ūdens pozitīvā ietekme uz aknu audu piesātinājumu ar skābekli: tajā pašā laikā pO2 pieaugums bija 15%, tas ir, šūnu elpošana palielinājās 1,3 reizes. Par relikvijas ūdens labvēlīgo ietekmi uz peļu veselību liecināja to paaugstinātā pretestība un svara pieaugums salīdzinājumā ar kontroli. Tas nozīmē, ka "vieglā" ūdens izmantošana lielo pilsētu iedzīvotājiem paaugstināta fona starojuma apstākļos ir pamatota.
"Vieglais" ūdens palielina vielmaiņas reakciju ātrumu, piemēram, novecošanās, metaboliskā sindroma, diabēta u.c. . Turklāt saskaņā ar provizoriskiem pētījumiem "vieglā" ūdens paraugos spermatozoīdi saglabāja savu funkcionālo aktivitāti nedaudz ilgāk, kas palielinās, samazinoties deitērija saturam ūdenī. Ja ņemam vērā vispārzināmo faktu, ka dzīvības vairošanās ir saistīta ar dzimumšūnu vitālās aktivitātes potenciālu, tad kļūs skaidrs reliktūdens nozīme nākamajām paaudzēm. Šie fakti veicina rūpniecisko iekārtu attīstību smago izotopu ieguvei no ūdens.
"Vieglais" ūdens palielina vielmaiņas reakciju ātrumu, piemēram, novecošanas laikā, metaboliskā sindroma laikā utt. Saskaņā ar provizoriskiem pētījumiem "vieglā" ūdens paraugos spermatozoīdi saglabāja savu funkcionālo aktivitāti nedaudz ilgāk.
Smagās izotopu atdalīšanas iekārtas
Pašlaik ir vairākas metodes smago izotopu ekstrakcijai no ūdens: izotopu apmaiņa pallādija un platīna klātbūtnē, ūdens elektrolīze kombinācijā ar katalītisko izotopu apmaiņu starp ūdeni un ūdeņradi, kolonnas destilācija, aukstu tvaiku sasaldēšana vakuumā, kam seko atkausēšana utt. .. Iegūšanas metodē ar deitēriju noplicināts dzeramais ūdens ledus sasalšanas-atkausēšanas dēļ ledus tiek iegūts, sasaldējot no avota ūdens radītos tvaikus temperatūrā, kas nepārsniedz +10 ° C, un ledus atkausēšanas procesā tas tiek papildus pakļauts ultravioletajam un infrasarkanajam starojumam un piesātina izkausēts ūdens ar gāzi vai gāzu maisījumu.
Sajaucot “vieglu” (H2O) un smago (D2O + T2O) ūdeni, notiek izotopu apmaiņa: H2O + D2O = 2 HDO; H2O + T2O = 2 HTO. Tāpēc deitērijs un tritijs parastajā ūdenī ir HDO un HTO formā. Šajā gadījumā sasalšanas temperatūra D2O ir +3,8 °C, bet T2O +9 °C, HDO un NTO sasalšanas temperatūra attiecīgi +1,9 °C un +4,5 °C. Konstatēts, ka temperatūrā no 0 līdz +1,9 °C ūdens molekulas ar deitēriju un tritiju, atšķirībā no „vieglā” (protium) ūdens, atrodas metastabilā cietā neaktīvā stāvoklī.
Šī īpašība ir pamatā "vieglā" un smagā ūdens daļējai atdalīšanai, radot gaisa retināšanu virs ūdens virsmas šajā temperatūrā. "Vieglais" ūdens intensīvi iztvaiko, un pēc tam to uztver saldētava, pārvēršoties ledū. "Smagais" ūdens, būdams neaktīvā cietā stāvoklī un ar daudz zemāku parciālo spiedienu, paliek avota ūdens iztvaicēšanas tvertnē kopā ar ūdenī izšķīdinātiem sāļiem un piemaisījumiem.
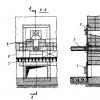
Konstruētais G.D. darbojas pēc šī principa. Berdiševs un I.N. Varnavskis kopā ar Ukrainas Krievijas Zinātņu akadēmijas R. Kavetska Eksperimentālās patoloģijas, onkoloģijas un radiobioloģijas institūtu rūpniecisko iekārtu VIN-4 "Nadiya" "vieglā" ūdens ražošanai ar samazinātu saturu par 30-35%. deitērija un tritija (2. att.).
Iekārta sastāv no korpusa 1, kurā atrodas iztvaicēšanas tvertne 2 avota ūdenim ar ierīcēm sildīšanai 3 un dzesēšanas ūdenim 4. Ir arī vārsts 5 ūdens padevei iztvaicētājam un vārsts 6 izlietoto atlikumu novadīšanai. bagātināts ar smagajiem ūdeņraža izotopiem. Korpusā ir arī ierīce 7 aukstu tvaiku kondensēšanai un sasaldēšanai plānsienu cauruļveida elementu komplekta veidā, kas ir savienoti ar sūkni aukstumaģenta sūknēšanai caur tiem. Ierīce 7 kopā ar ultravioletā 8 un infrasarkanā 9 starojuma avotiem ir novietota virs tvertnes 10 kausējuma ūdens savākšanai. Korpusa 1 iekšējo dobumu savieno atzarojuma caurule 11 ar vakuumsūkni - gaisa izplūdes avotu. Turklāt korpuss 1 ir aprīkots ar ierīci 12 attīrīta gaisa vai gāzu maisījuma ievadīšanai iekārtas iekšējā dobumā. Turklāt iekārta VIN-4 ir aprīkota ar termiskās kontroles sistēmu iztvaicēšanas tvertnes 2 dobumā, lai kontrolētu sākotnēji apstrādātā ūdens iztvaikošanas procesa iestatīto temperatūru. Korpusam ir iluminatori 13 un 14 iztvaikošanas, auksto tvaiku sasalšanas un ledus kušanas procesu uzraudzībai. Izkausētā ūdens savākšanas tvertne 10 ir aprīkota ar vārstiem 15 kausētā ūdens novadīšanai un atzarojuma cauruli 16 savienošanai ar bloku kausētā ūdens 17 struktūras un īpašību veidošanai. Blokā 17 ir iekļauts iekšējais konisks konteiners 18 ar minerālvielām. Tvertnes 19 izejā ir uzstādīts adsorbcijas filtrs 20 un drenāžas vārsts 21.

Konstatēts, ka temperatūrā no 0 līdz +1,9 °C ūdens molekulas ar deitēriju un tritiju atšķirībā no "vieglā" ūdens atrodas metastabilā cietā neaktīvā stāvoklī.
Uzstādīšana darbojas šādi. No ūdens caurules iztvaicēšanas tvertne 2 ir piepildīta ar ūdeni un aukstumaģents tiek sūknēts caur ierīci 4. Sasniedzot iestatīto temperatūru, kas nepārsniedz +10 °C, ūdens dzesēšanas process tiek apturēts. Pēc tam korpuss 1 tiek noslēgts un gaiss tiek izsūknēts caur cauruli 11, radot vakuumu uzstādīšanas korpusa iekšējā tilpumā. Reta veidošanās notiek vispirms ar tajā izšķīdušo gāzu intensīvu izdalīšanos no visa avota ūdens tilpuma un to izvadīšanu, bet pēc tam ar intensīvu iztvaikošanu līdz ūdens vārīšanās temperatūrai, kas vērojama caur 13. un 14. logu. rezultātā aukstie tvaiki kondensējas un sasalst uz saldētavas cauruļveida elementu virsmas 7. Kad ledus biezums sasniedz iepriekš noteiktu vērtību, iztvaikošanas process tiek apturēts. Vakuuma sūknis tiek izslēgts, tiek ieslēgti ultravioletā 8 un infrasarkanā starojuma avoti 9, un caur ierīci 12 korpusa 1 dobumā tiek ievadīts attīrīts gaiss vai gāzu maisījums; tad paaugstiniet spiedienu korpusā 1 līdz atmosfēras līmenim vai virs tā. Pārējais ūdens tvertnē 2, kas bagātināts ar smagajiem izotopiem, tiek novadīts caur vārstu 6 atsevišķos traukos vai novadīts uzglabāšanas tvertnē. Ledus apstarojot un kūstot, kausētais ūdens nonāk tvertnē 10, pēc tam uz bloku 17, lai veidotu kausētā ūdens struktūru un īpašības. Izejot cauri iekšējo 18 un ārējo 19 konisko konteineru minerāliem un tālāk caur filtru 20, kausētais ūdens pabeidz savu ceļojumu, iegūstot ārstnieciskas bioloģiski aktīvas īpašības.
Līdzīgu iekārtu bioloģiski aktīva dzeramā ūdens ar zemu deitērija saturu iegūšanai ar elektrolīzi 2000. gadā projektēja Krievijas zinātnieki Yu.E. Sinjaks, V.B. Gaidadymovs un A.I. Grigorjevs no Biomedicīnas problēmu institūta (3. att.). Iekārtā ir konteiners 1 ar atmosfēras mitruma kondensātu vai destilātu, kas savienots ar kameras anoda kameru 2 ar jonu apmaiņas elektrolītu. Elektrolīzerā ir poraini elektrodi (2. anods un 3. katods), kas izgatavoti no titāna, kas pārklāts ar platīnu, elektrolīzes gāzu pārveidotājs ūdenī, kondensators 10 un "viegla" ūdens kolekcija. Papildus iekārta papildus aprīkota ar skābekļa žāvētāju 4, izotopu D2/H2O apmaiņas reaktoru 5, kura ārējās sānu sienas veidotas no jonu apmaiņas membrānām un ūdens kondicionētāju 11. Reaktora ārsienas 5 un žāvētājs 4 ir veidots no jonu apmaiņas membrānām 6, 8; skābekļa žāvētājā ir jonu apmaiņas katjonu apmaiņas iekārta, savukārt ūdens kondicionētājs 11 ir veidots no filtra ar jauktiem jonu apmaiņas materiālu slāņiem - adsorbentu un mineralizatoru, kas satur granulētus kalcija-magnija karbonāta materiālus.
Atmosfēras mitruma kondensāts jeb destilāts ar cieto elektrolītu nonāk elektrolizatora anoda kamerā, kur elektrolīzes process tiek veikts 60-80 °C temperatūrā. Ar deitēriju noplicinātais gāzveida ūdeņradis un skābeklis, kas veidojas elektrolīzes rezultātā ar ūdens tvaikiem, tiek ievadīti skābekļa žāvētājā 4, kur žāvēšana notiek ūdens tvaiku sorbcijas rezultātā ar jonu apmaiņas pildvielu (katjonu apmaiņas līdzekli) un cauri jonu apmaiņai. apmaiņas membrānas 6. Pēc tam izžāvētais elektrolītiskais ūdeņradis tiek ievadīts katalītiskā izotopu apmaiņas reaktorā 5, kur tam tiek veikta izotopu D2/H2O apmaiņa ar ūdens tvaikiem un ūdeņradi uz katalizatora, kas sastāv no aktīvās ogles, pievienojot 4-10% fluoroplasta un 2-4°% pallādija vai platīna. Pēc izotopu D2/H2O apmaiņas ūdeņradis tiek žāvēts no ūdens tvaikiem (D2O), kas tiek sorbēti un izņemti caur 8. reaktora jonu apmainītājiem, kas novietoti uz tā ārējām sānu sienām. Izžuvušās gāzes nonāk elektrolīzes gāzu pārveidotājā un katalītiskajā degli 9. Degļa liesma tiek nosūtīta uz kondensatoru 10, atdzesēta kanālā ar krāna ūdeni, kur ūdens tvaiki tiek kondensēti un nonāk gaisa kondicionētājā 11 pēcapstrādei. apstrāde uz sorbcijas filtra. Pēc tam ūdens nonāk deitērija 12 noplicinātā ūdens kolektorā. Ierīces dzesēšana un jonu apmaiņas membrānu darbība elektrolīzes gāzu žāvēšanai no ūdens tvaikiem tiek veikta ar ventilatoru 7. Tiek veikta galīgā ūdens attīrīšana un sekojošā mineralizācija. ārā ar kalciju-magniju saturošiem karbonātu minerāliem un dolomītu. Instalācijas produktivitāte "vieglajam" ūdenim ir 50 ml ūdens stundā.
Vakuuma sasaldēšanas-atkausēšanas laikā tiek iegūts mikromineralizēts dzeramais ūdens ar par 10-35% samazinātu deitērija saturu un sakārtotu, kausējam ūdenim raksturīgu ledus līdzīgu struktūru.
Elektrolīzes procesā ūdens ar deitērija saturu, kas samazināts par 60% vai vairāk, saglabā destilētā ūdens negatīvās īpašības (mineralizācijas trūkums, palielināts izšķīdušo gāzu saturs, nesakārtota ūdens molekulārā struktūra). Tas ir izejmateriāls dzeramā ūdens iegūšanai astronautiem. Elektrolīzes procesa priekšrocība ir maksimāli iespējamā deitērija noņemšana (līdz 90 °%).
Vakuuma sasaldēšanas-atkausēšanas laikā tiek iegūts mikromineralizēts dzeramais ūdens ar par 10-35% samazinātu deitērija saturu un sakārtotu, kausējam ūdenim raksturīgu ledus līdzīgu struktūru. Tāpēc priekšroka tiek dota šai "viegla" ūdens iegūšanas metodei.
Projektēts iekšā pēdējie gadi kombinētās izotopu apmaiņas un rektifikācijas metodes ļauj iegūt “vieglu” ūdeni ar augstu izotopu tīrību. Pasaulē pirmo destilācijas iekārtu izotopu ūdens attīrīšanai 1975. gadā projektēja Šveices uzņēmums Sulzer, un tā tika nodota ekspluatācijā HFR ILL reaktorā. 1987. gadā līdzīgs, bet daudz jaudīgāks bloks tika uzbūvēts Kanādā Kanādas atomelektrostacijām.

90. gadu beigās B.P. Konstantinovs, tika izveidota pirmā sadzīves destilācijas kolonna ūdens izotopu atdalīšanai. Kolonnas augstums - 10 m, diametrs - 80 mm. Šī iekārta ir balstīta uz kombinētu izotopu apmaiņas metodi "ūdens-ūdeņraža tvaiku" sistēmā un ūdeņraža izotopu destilāciju zemā temperatūrā.
Katalītiskā izotopu apmaiņas (COI) reakcijas laikā starp ūdens tvaiku un deitēriju 200 °C temperatūrā protijs un tritijs tiek ekstrahēti no "smagā" ūdens un pēc tam pārnesti uz gāzveida fāzi:
DOT+D2=DT+D2O,
HDO + D2 = DH + D2O.
Tritija ekstrakcijas pakāpi no "smagā" ūdens nosaka līdzsvara konstante, un ar trīspakāpju attīrīšanu tā nav lielāka par 30 °%. Attīrīts no protija un tritija "smagais" ūdens tiek atgriezts reaktorā. Ūdeņraža izotopu D2, DT, HD maisījumu pēc attīrīšanas no piemaisījumiem un atdzesēšanas līdz 25 K temperatūrai ievada zemas temperatūras kolonnā. Pateicoties masas pārneses procesiem starp ūdeņraža izotopu gāzveida un šķidro fāzi, tritijs koncentrējas kolonnas apakšējā daļā, bet protijs - augšējā daļā. Protija un tritija noplicinātā deitērija plūsma D2O veidā tiek atgriezta KIO vienībā. Protija koncentrāts tiek ņemts no zemas temperatūras kolonnas augšējās daļas "vieglā" ūdens veidā, bet tritija koncentrāts tiek ņemts no apakšējās daļas tritija ūdens veidā.
Ūdens rektifikācija attiecas uz masas pārneses procesiem un tiek veikta pretstrāvas kolonnu aparātos ar kontaktelementiem - sprauslām vai plāksnēm. Šajā procesā notiek nepārtraukta apmaiņa starp šķidruma un tvaika ūdens fāzes molekulām, kas pārvietojas viena pret otru. Šajā gadījumā šķidrā fāze tiek bagātināta ar komponentu ar augstāku viršanas temperatūru, bet tvaika fāze tiek bagātināta ar zemākas viršanas temperatūras deitēriju un citiem smagajiem izotopiem - tritiju (T) un skābekli (18O).


Vairumā gadījumu rektifikācija tiek veikta pretstrāvas kolonnu aparātos ar dažādiem kontaktelementiem.
Vairumā gadījumu rektifikācija tiek veikta pretstrāvas kolonnu aparātos ar dažādiem kontaktelementiem (4. att.). Masas pārneses process notiek visā kolonnas augstumā starp flegmu, kas plūst uz leju, un tvaiku, kas paceļas uz augšu. Lai pastiprinātu masas pārneses procesu, tiek izmantotas sprauslas un plāksnes, kas ļauj palielināt masas pārneses virsmu. Izmantojot iepakojumu, šķidrums plānā kārtiņā plūst uz leju pa tā virsmu, bet, izmantojot paplātes, tvaiki iziet cauri šķidruma slānim uz paplātes virsmas.
Destilācijas kolonnu aprēķina pēc ūdens viršanas diagrammas dotajiem rektifikācijas parametriem - avota ūdens sastāvam, destilācijas atlikumam, destilātam, produktivitātei un darba spiedienam kolonnā. Pēc tam tiek izvēlēts paplāšu veids un skaits, noteikts tvaika ātrums, kolonnas diametrs, masas pārneses koeficienti, kolonnas augstums, paliktņu hidrauliskā pretestība. Pēc tam tiek aprēķinātas veiktspējas īpašības, kā arī destilācijas kolonnas izmantošanas ekonomiskie rādītāji. Praksē dziļākai ūdens attīrīšanai no smagajiem izotopiem izmanto nevis vienu destilācijas kolonnu, bet desmit vai vairāk atsevišķu kolonnu bateriju (līdz 20).
Šai ūdens izotopu atdalīšanas metodei ir vairākas būtiskas priekšrocības salīdzinājumā ar esošie veidi un ļauj attīrīt dabisko ūdeni no deitērija līdz vērtībām 20-30 ppm. Turklāt izotopu ūdens attīrīšanas produktivitāte ar šo metodi ir augstāka nekā citām metodēm, kas ievērojami samazina tās izmaksas. Tiek pieļauts, ka līdz ar "vieglā" ūdens vērienīgu ražošanu nākotnē tas kļūs pieejams ikvienam.
IN Nesen Vietējā tirgū parādījās “vieglais” dzeramais ūdens “Langvey”, kas tiek ražots ar kolonnas rektifikācijas metodi ar dažādu atlikuma deitērija saturu (no 125 līdz 50 ppm) (3. tabula).


Pamatojoties uz klīniskajiem pētījumiem, kas veikti Krievijas Atjaunojošās medicīnas un balneoloģijas zinātniskajā centrā un Skaistuma institūtā, “Langvey” “viegls” dzeramais ūdens ir ieteicams ogļhidrātu un lipīdu metabolisma normalizēšanai, asinsspiediena, svara korekcijai, ķermeņa funkcionēšanas uzlabošanai. kuņģa-zarnu traktā, palielinot ūdens apmaiņas ātrumu un toksīnu izvadīšanu no organisma.
"Vieglā" ūdens galvenā ietekme uz ķermeni ir izskaidrojama ar pakāpenisku deitērija satura samazināšanos ķermeņa fizioloģiskajos šķidrumos izotopu H-D apmaiņas reakciju dēļ. Iegūto rezultātu analīze var liecināt, ka ķermeņa ūdens attīrīšana no "smagā" ūdens ar "vieglā" dzeramā ūdens palīdzību uzlabo dažu dzīvībai svarīgu ķermeņa sistēmu darbību. Regulāri patērējot "vieglu" ūdeni, notiek pilnīgāka visa organisma attīrīšanās no "smagā" ūdens, pateicoties izotopu H-D apmaiņas reakcijām fizioloģiskos šķidrumos, kā arī urīna izotopu sastāva un kalcija satura izmaiņām. tajā ir ierakstīti. "Vieglā" dzeramā ūdens ikdienas lietošana ļauj dabiski samazināt "smagā" ūdens saturu cilvēka organismā, pateicoties izotopu H-D apmaiņas reakcijām. Šo procesu pavada šūnu, orgānu un dažu ķermeņa sistēmu funkcionālās aktivitātes palielināšanās. Tajā pašā laikā tiek normalizēti vielmaiņas procesi, palielinās ķermeņa aizsargspējas un izturība pret ārējām nelabvēlīgām ietekmēm.
Regulāra "viegla" dzeramā ūdens lietošana ļauj dabiski samazināt "smagā" ūdens saturu cilvēka organismā līdz 111 ppm. Tas labvēlīgi ietekmē vielmaiņu, uzlabo pašsajūtu, paaugstina efektivitāti, kā arī veicina ātru organisma atjaunošanos pēc smagas fiziskas slodzes.
"Vieglā" dzeramā ūdens pozitīvās īpašības apstiprina pētījumi un klīniskie pētījumi. Ir pierādīts, ka "viegls" ūdens normalizē vielmaiņu un asinsspiedienu, samazina cukura līmeni asinīs pacientiem cukura diabēts II tips, attīra organismu no toksīniem un toksīniem, veicina ātru sadzīšanu un kaulu un muskuļu audu atjaunošanos pēc traumām, piemīt pretiekaisuma iedarbība, pastiprina iedarbību zāles, veicina svara korekciju, aizsargā šūnas no starojuma, novērš pēcalkohola abstinences pazīmes. "Vieglo" ūdeni ieteicams lietot arī ātrai un dziļai organisma attīrīšanai, kas nepieciešama vielmaiņas traucējumu gadījumā, pirms operācijas un pēcoperācijas periodā, kā arī audzēju slimību ārstēšanā.

"Vieglais" ūdens normalizē vielmaiņu un asinsspiedienu, samazina cukura saturu, attīra organismu no toksīniem un toksīniem, veicina ātru sadzīšanu un kaulu un muskuļu audu atjaunošanos pēc traumām, piemīt pretiekaisuma iedarbība
Krievijas Federācijas Veselības ministrijas Krievijas Atjaunojošās medicīnas un balneoloģijas pētniecības centra veiktie "vieglā" ūdens klīniskie pētījumi ar atlikušā deitērija saturu 60-100 ppm parādīja, ka to var ieteikt kā palīglīdzekli kompleksa ārstēšana pacientiem ar metabolisko sindromu (arteriālo hipertensiju, aptaukošanos, traucētu ogļhidrātu metabolismu, dislipidēmiju) un cukura diabētu.
Turklāt ir konstatēts, ka "vieglais" ūdens uzlabo dzīves kvalitāti nefrolitiāzes un dažādi pārkāpumi kuņģa-zarnu trakta darbā (kolīts un gastrīts). Ņemot vērā ūdens sadalījuma dinamiku organismā, izotopu (H/D un 16O/18O) apmaiņas reakcijas un ar "vieglu" ūdeni iegūtos rezultātus, varam sagaidīt, ka vislielākais efekts izotopu ūdens attīrīšana ietekmēs organisma regulēšanas sistēmas un vielmaiņu.
“Vieglā” ūdens iedarbības efektivitāte ir atkarīga no daudziem parametriem – ķermeņa svara, ūdens daudzuma organismā, ikdienā izdzertā “vieglā” ūdens daudzuma un tā izotopiskās tīrības pakāpes. Tabulā. 4. attēlā parādīti deitērija satura izmaiņu aprēķinu rezultāti organismā, regulāri lietojot "vieglu" ūdeni ar dažādu atlikuma deitērija saturu.
Aprēķins veikts, pamatojoties uz šādiem datiem: ikdienas "vieglā" ūdens patēriņš - 1,0 vai 1,5 litri; ikdienas ūdens apmaiņa - 2,5 l; deitērija saturs organismā atbilst tā saturam dabiskajā ūdenī - aptuveni 150 ppm; ūdens tilpums organismā ir 45 litri (ķermeņa svars ir aptuveni 75 kg).
Izpētītās "vieglā" ūdens pozitīvās īpašības ļauj runāt par turpmākajām "vieglā" ūdens izmantošanas perspektīvām medicīnā, sadzīvē un pārtikas rūpniecībā. Nākotnē tiek plānoti eksperimenti, kuros astronauti patērēs "vieglu ūdeni", jo "vieglā" ūdens pretradiācijas īpašības ir īpaši svarīgas kosmosa lidojumiem.

Secinājums
Gaismas ūdens ir pēc savas struktūras un sastāva sarežģīta dabiskā ūdens izotopu šķirne, kam ir polifizioloģiska iedarbība uz cilvēka organismu – pretaudzēju, radioaizsargājošs un vispārārstniecisks. "Vieglā" ūdens galvenā ietekme uz ķermeni ir pakāpeniska deitērija satura samazināšanās, ko izraisa izotopu H-D apmaiņas reakcijas fizioloģiskajos šķidrumos. Iegūto rezultātu analīze ļauj apgalvot, ka ķermeņa attīrīšana no "smagā" ūdens ar "vieglā" ūdens palīdzību var būtiski uzlabot svarīgāko organisma dzīvībai svarīgo sistēmu darbību.
Ņemot vērā ūdens lomu organismā, "smagā" ūdens aprēķinātos izotopu efektus un rezultātus, kas iegūti uz "vieglu" ūdeni, var sagaidīt, ka vislielākā ietekme var ietekmēt organisma regulēšanas sistēmas, vielmaiņu un enerģētisko aparātu. dzīvu šūnu, tas ir, tieši tās šūnu sistēmas, kas izmanto augstu protonu mobilitāti (D) un liels ātrumsūdeņraža H+ un D- saišu pārrāvums. Turklāt “vieglajam” ūdenim ir zemāka viskozitāte nekā “smagajam”, kas ļauj tam vieglāk iekļūt šūnu membrānās un tādējādi regulēt ūdens apmaiņas ātrumu organismā. Neorganisko sāļu šķīdība vieglajā ūdenī ir nedaudz augstāka nekā smagajā ūdenī, kas ļauj efektīvāk izvadīt no organisma vielmaiņas produktus un kaitīgos sāļu piemaisījumus. Enzīmu (katalītisko) reakciju ātrums vieglā ūdenī ir nedaudz lielāks nekā parastajā ūdenī. Tas ļauj pastiprināt vielmaiņas procesus, kas palīdz organismam ātrāk atgūties pēc lielām slodzēm. Tādējādi "viegls" ūdens ļauj dabiski, neizmantojot nekādus farmaceitiskos līdzekļus, ievērojami palielināt ķermeņa vielmaiņas procesus.
Ūdens ūdeņradim ir trīs izotopi: protijs 1H (protons + elektrons), deitērijs 2H vai D (protons + neitrons + elektrons), tritijs 3H vai T (protons + divi neitroni + elektrons), ar masas skaitļiem attiecīgi 1, 2 un 3. Protijs un deitērijs ir stabili izotopi. Tritijs - beta ir radioaktīvs, pussabrukšanas periods ir 12,26 gadi. H atomiem ir dažādas ierosmes pakāpes.
Bez ūdeņraža izotopi tika atrasti arī skābeklī, tie ir pieci, izņemot labi zināmo stabilo izotopu O16 (ar molekulmasu 16). Trīs no tiem izrādījās radioaktīvi - O14, O15 un O19, un O17 un O18 - stabili. O16, O17 un O18 atrodas visos dabiskajos ūdeņos, un to attiecība (ar svārstībām līdz 1%) ir šāda: 4 daļas O17 un 20 daļas O18 nokrīt uz 10 000 daļām O16.
Fizikālo īpašību ziņā smagais skābekļa ūdens atšķiras no parastā ūdens mazāk nekā smagais ūdeņraža ūdens. To iegūst no dabīgā ūdens ar frakcionētu destilāciju un izmanto kā narkotiku avotu ar marķētu skābekli.
Ņemot vērā visu ūdeņraža un skābekļa izotopu sastāva daudzveidību, var runāt par ļoti dažādām ūdens izotopu šķirnēm. Deviņi no tiem satur tikai stabilus izotopus un veido galveno dabiskā ūdens saturu. Tajā dominē parasts ūdens H12O16 (99,73%), kam seko smagā skābekļa ūdens H12O17 (0,04%) un H12O18 (0,2%), kā arī smagā ūdens izotopu šķirne H1D1O16 (0,03%).
Skābeklis cilvēkā ir 60%, bet pēc atomu skaita visas dzīvās būtnes sastāv no 2/3 ūdeņraža atomu un ¼ skābekļa atomu. Izotopu attiecība: P:D = 1:4700 iekšējos ūdeņos, P:D = 1:6800 atomi iekšzemes ūdeņos jūras ūdens. Tas ir, koncentrācija kontinentālajos ūdeņos D = 0,0135 at.% vai 0,015 masas%, jūras ūdenī D = 0,015 at.% vai 0,017 masas%. Dabiskajā ūdenī tritija saturs ir niecīgs - tikai 10-18 atomprocenti. Tomēr tas ir atrodams arī dzeramajā ūdenī.
Atkarībā no ūdeņraža izotopu (H, D, T) un skābekļa (O14, O15, O16, O17, O18, O19) veida un satura, pēc tīrības un piesārņojuma pakāpes pētnieki izšķir vairāk nekā tūkstoti dzeramā ūdens šķirņu.
Ūdens molekulas atšķiras viena no otras pēc izotopu sastāva. Pašlaik ir zināmi 5 dažādi ūdeņraža izotopi. No tiem tikai divi ir stabili: vieglākais protijs - ar atomu masu 1, to apzīmē ar simbolu 1H - sastāv no 1 protona un 1 elektrona, un smagais ūdeņradis jeb deitērijs ar atomu masu 2, tas ir apzīmē ar simbolu 2D – sastāv no 1 protona, 1 neitrona un 1 elektrona. Trešais supersmagais ūdeņradis (ar atomu masu 3) attiecīgi sastāv no 1 protona, 2 neitroniem un 1 elektrona. Tritijs ir radioaktīvs, tā pussabrukšanas periods ir aptuveni 12,3 gadi. Citu izotopu kalpošanas laiks nepārsniedz dažas sekundes.
Skābeklim ir seši izotopi: O14 O15, O16, O17, O18 un O19. Trīs no tiem: O16, O17 un O18 ir stabili, un O14, O15 un O19 ir radioaktīvie izotopi. Stabili skābekļa izotopi ir sastopami visos dabiskajos ūdeņos: to attiecība ir šāda: uz 10 000 daļām O16 ir 4 daļas O17 un 20 daļas O18.
Ūdens izotopiskā jeb izotopiskā iedarbība ir balstīta uz ūdeņraža un skābekļa izotopu īpašību atšķirībām to atomu masu, inerces momentu un atbilstošo ķīmisko saišu stipruma dēļ. Izotopu masu relatīvā atšķirība ir jo mazāka, jo lielāks ir elementa atomu skaits. Ūdeņraža izotopiem tas ir 100% deitērijam D (2H) un 200% tritijam T (3H), salīdzinot ar protiju H (1H). Tāpēc ūdeņradim izotopu ietekme ir visizteiktākā.
Ir 42 ūdens izotopologi (dažādu izotopu atomu kombinācijas veido izotopologu molekulu kopu1) ūdenim (ieskaitot stabilus un nestabilus ūdeņraža un skābekļa izotopus). No tām trīsdesmit trīs ūdens molekulas ir radioaktīvas, un deviņas ir stabilas, stabilas ūdens molekulas.
Molekulu ar atšķirīgu izotopu sastāvu veidošanās varbūtība nav vienāda. Visizplatītākā ir molekula ar mazāko masu, kas sastāv no ūdeņraža - 1 (protium) un skābekļa - 16. Citu smagāku molekulu saturs dabā nepārsniedz 0,23%, ūdens izotopu modifikāciju saturs dabā uzrādīts Tabula. 1.
Pasaules praksē ir ierasts deitērija saturu izteikt ‰ vai ppm. Ppm ir monodeuterēto ūdens molekulu skaits uz 1 miljonu molekulu, kas satur tikai vieglo 1H izotopu. Ūdenim iztvaikojot no okeāna virsmas, deitērija saturs mainās par 20 ppm.
Slēgtajās rezervuāros ir vairāk smagā ūdens, jo, salīdzinot ar parasto ūdeni, tas iztvaiko mazāk intensīvi. Tāpēc apgabalos ar karstu klimatu ir vairāk smagā ūdens.
Okeāna virsma ir bagātināta arī ar deitēriju pie ekvatora (155 ppm) un tropos, kur veicina biežie nokrišņi, kuru veidošanās laikā no tvaiku fāzes kondensējas ūdens, bet smagais ūdens kondensējas ātrāk nekā vieglais, tāpēc nokrišņi ir bagātināts ar smago ūdeni.
Zemākais 2H saturs ūdens tvaikos virs Antarktikas ledus? 90 ppm. Arī deitērija īpatsvars Grenlandes ledū ir neliels (126 ppm). Deitērija saturs dažādas izcelsmes dabiskajos ūdeņos ir parādīts tabulā. 2.
Ir vērts pievērst uzmanību faktam, ka deitērija saturs Irkutskas apgabala dabiskajos ūdeņos ir zemāks nekā Krievijas Eiropas daļā un Eiropā. Tādējādi Baikālā D/H ir 137,0 ppm, bet dažos minerālavotos - 132,0 ppm, savukārt D saturs līdzīgos avotos Eiropā ir vismaz 145-150 ppm. Šādus datus var izmantot, lai identificētu minerālūdeņu un galda ūdeņu avotus (2. tabula).
Skābekļa izotopu (O 16, O 17, O 18) un ūdeņraža (H 1, H 2, H 3) izpēte parādīja, ka atkarībā no to kombinācijām var pastāvēt 18 dažādi ūdens veidi. Tagad ir pievērsta īpaša uzmanība smags vai miris ūdens (H 2 2 O vai D 2 O), kas atšķiras no tīrs ūdensīpašs bioloģiskās īpašības. Sēklas tajā nedīgst, tas ir nāvējošs dažādiem organismiem. Tomēr šī ūdens saturs parasti ir niecīgs un tam nav kaitīgas ietekmes. Smagā ūdens blīvums ir 1,106, maksimālais blīvums ir + 11,8 0 С, t bp. \u003d 101,42 0, t izkausēt. = 3,82.
Ūdeņraža izotopu izpēte ir parādījusi, ka to dabiskā frakcionēšana ir atkarīga no daudziem faktoriem. Palielinoties ūdeņu (nogulšņu ūdeņu) vecumam, palielinās deitērija daudzums; kristalizācijas ūdens, kā arī ūdens, kas atrodas augu un dzīvnieku audos, izrādījās smagāks par parasto ūdeni. Īpaši smaga ūdens (T 2 O 18 vai H 2 3 O 18) blīvums ir 24, t.i. tas ir par 33% smagāks par parasto ūdeni. Īpaša gravitāte tā 1.332, t kip. 103-105 0 C, ledus kušanas temperatūra 8-10 0 , lielākā blīvuma punkts 18-20 0 C.
Daži pētnieki (A.S. Uklonskis un citi) uzskata, ka skābeklis O 16 ir raksturīgs atmosfēras ūdenim, ūdenim uz Zemes virsmas un gruntsūdeņiem, ko baro atmosfēras nokrišņi; O 17 - okeāniem un O 18 - litosfēras dziļajiem ūdeņiem. Pilnīgi iespējams, ka ūdens izotopu sastāva mainīgums līdz ar struktūru ir viens no ūdenim raksturīgo anomāliju izpausmes iemesliem.
14.4. Ūdens fizikālās īpašības
Dabisko ūdeņu galvenās fizikālās īpašības, kuras parasti nosaka hidroģeoloģiskajos pētījumos, ir: temperatūra, krāsa, caurspīdīgums, garša, smarža, īpatnējais svars.
Temperatūra.
Gruntsūdeņu temperatūra ir ļoti atšķirīga: no mīnus mūžīgā sasaluma zonā (-13,5 0 С) līdz pārkarsētu tvaiku temperatūrai (> 120 0 С) jaunās vulkāniskās aktivitātes zonās un lielā dziļumā. Ūdens temperatūrai ir noteikta ietekme uz ķīmiskais sastāvs. Temperatūras paaugstināšanās palielina molekulu kustības ātrumu šķīdumā un vairuma fizikālo un ķīmisko reakciju ātrumu (Ostvalda likums). Ūdens temperatūras noteikšana tiek veikta ar dažādiem termometriem, tiek izmantoti tā sauktie pavasara termometri (slinkie), kā arī maksimālie un minimālie. Jutīgāki un precīzāki ir elektriskie termometri un elektroniskie sensori.
Pārredzamība.
Ūdens caurspīdīgums ir atkarīgs no tajā esošo suspendēto daļiņu daudzuma. Kvalitatīvi to nosaka mēģenē, kurā ielej 10 ml ūdens. Skatoties no augšas, nosakiet ūdens caurspīdīguma pakāpi atbilstoši nomenklatūrai: caurspīdīgs, nedaudz opalescējošs, opalescējošs, nedaudz duļķains, duļķains, ļoti duļķains. kvantitatīvā noteikšana caurspīdīgās plēves tiek veiktas ierīcē - cilindrā ar trīsdimensiju plakanu grunts dibenu, graduēts centimetros augstumā. Caurspīdīgumu izsaka kolonnas augstuma centimetros ar precizitāti 0,5 cm. Lai noteiktu suspendēto daļiņu daudzumu, ūdens paraugu (0,5-1,0 l) sakrata un filtrē caur nosvērtu tīģeli ar porainu dibenu vai caur nosvērtu filtru, pēc tam žāvē un nosver. Ja stāvēšanas laikā mainās ūdens caurspīdīgums, tie raksturo nogulsnes (nav, nenozīmīgas, pamanāmas, lielas) un pēc kvalitātes (kristālisks, pārslains, duļķains, smilšains utt.), norādot to krāsu.
Krāsa.
Ūdens krāsa zināmā mērā raksturo tā kvalitāti. Ķīmiski tīrs ūdens tas ir bezkrāsains, un tikai vairākus metrus biezā slānī iegūst zilu krāsu. Ūdeni iekrāso mehāniski piemaisījumi. Dzeltenīgā krāsa ir raksturīga humusvielas saturošiem purvu ūdeņiem. Dažreiz ūdenim ir tējas krāsa (R. Chaya). Ūdens kļūst melns, jo virsmas apstākļos pēc tā ekstrakcijas no dziļuma veidojas dzelzs monosulfīds.
Kvalitatīvu krāsas noteikšanu veic tīrā ūdenī, mēģenē, zem kuras aizvieto baltu papīru. Ūdens krāsu raksturo šādi: bezkrāsains, zaļgans, dzeltenīgs, brūns utt.
Kvantitatīvu noteikšanu veic, salīdzinot testa ūdeni, kas ielej 100 ml bezkrāsaina stikla cilindrā ar augstumu 20 cm, ar standarta platīna-kobalta šķīdumu, kas ielej tajā pašā cilindrā, skatoties uz balta fona.
Nogaršot.
Ūdens garša ir atkarīga no tajā izšķīdušo vielu sastāva. Piemēram, sāļu garšu izraisa NaCl, rūgtu – MgSO 4 , rūsu vai tintes garšu – dzelzs sāļi. Ar organiskām vielām bagātiem ūdeņiem ir saldena garša.
Garšas noteikšanai ūdeni uzsilda līdz 30 0 C, apmēram 15 ml ņem mutē un tur vairākas sekundes. Ir: sāļa, rūgta, saldskāba garša, kā arī smaka: hlora, zivju, metāliska u.c.
Smarža.
Ūdens smaka liecina vai nu par bioķīmiskas izcelsmes gāzu (H 2 S u.c.) klātbūtni, vai arī par bojājošos organisko vielu klātbūtni.
Viņi uzsilda ūdeni mēģenē ar aizbāzni un pēc tam to izšņauc, smaržas raksturs: bez smaržas, sērūdeņradis, purvs, māls, sapelējis utt. pēc punktiem (no 0 līdz 5).
Īpatnējais svars (blīvums, g/cm 3 ).
Atkarīgs no mineralizācijas vērtības, temperatūras, gāzes piesātinājuma utt.). To nosaka: aptuveni - ar hidrometru, precīzi - ar piknometru, noteiktā temperatūrā.