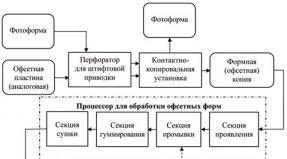
Оборудование для производства азота. Получение азота Производство азота из воздуха
Так как свободный азот содержится в атмосфере, получение его сводится к отделению от кислорода и других составных частей воздуха. Это осуществляется постепенным испарением жидкого воздуха в специальных установках, причем одновременно получаются также кислород и инертные газы.
Азот представляет собой бесцветный и не имеющий запаха газ (т. пл. -210°С, т. кип. -196°С). Растворимость его в воде мала - около 2% по объему. Молекула азота двухатомна и заметно не распадается на атомы даже при очень высоких температурах.
Свободный азот химически весьма инертен. В обычных условиях он не реагирует ни с металлоидами, ни с металлами (кроме Li). При повышении температуры его активность увеличивается главным образом по отношению к металлам, с некоторыми из которых он при нагревании соединяется, образуя нитриды этих металлов (например, Mg 3 N 2).
3Mg + N 2 = Mg 3 N 2
Применение свободного азота, как такового, довольно ограниченно. Главным образом его используют для заполнения электроламп. Соединения азота имеют громадное значение для биологии и используются в разнообразных отраслях промышленности. Наибольшие их количества расходуются в качестве минеральных удобрений и при производстве взрывчатых веществ.
Основным исходным продуктом для промышленного получения азотных соединений является свободный азот воздуха. Перевод его в связанное состояние осуществляется главным образом методом синтеза аммиака, разработанным в 1913 г.
Приложение к обратимой реакции
N 2 + ЗН 2 < = > 2NH 3 + 22 ккал
принципа смещения равновесий показывает, что наиболее выгодными для образования аммиака условиями являются возможно низкая температура и возможно высокое давление. Однако даже при 700°С скорость реакции настолько мала (и следовательно, равновесие устанавливается так медленно), что не может быть и речи о ее практическом использовании. Напротив, при более высоких температурах, когда равновесное состояние устанавливается быстро, ничтожно малым становится содержание аммиака в системе. Таким образом, техническое проведение рассматриваемого процесса оказывается как будто невозможным, так как, ускоряя достижение равновесия при помощи нагревания, мы одновременно смещаем положение равновесия в невыгодную сторону.
Существует, однако, средство ускорить достижение равновесного состояния без одновременного смещения равновесия. Таким часто помогающим средством является применение подходящего катализатора.
Хорошо действующим оказалось в данном случае металлическое железо (с примесью Аl 2 О 3 и К 2 О).
Процесс синтеза аммиака ведут при температурах 400-550°С (на катализаторе) и давлениях 100-1000 ат.
Равновесие устанавливается при этом достаточно быстро. После выделения аммиака из газовой смеси последняя вновь вводится в цикл. За четверть века, с 1913 до 1938 г., ежегодная мировая продукция связанного таким путем азота возросла от 7 т до 1700 тыс. т. В настоящее время синтез аммиака является основным промышленным методом получения связанного азота.
Значительно меньшее промышленное значение имеет разработанный в 1901 г. цианамидный метод, который основан на том, что при высоких температурах карбид кальция (получаемый накаливанием смеси извести и угля в электрической печи) реагирует со свободным азотом по уравнению
CaC 2 + N 2 = CaCN 2 + C + 70 ккал
Полученный таким путем цианамид кальция (Ca = N-C?N) представляет собой серый (от примеси углерода) порошок. При действии перегретого (т.е. нагретого выше 100°С) водяного пара он разлагается с выделением аммиака:
CaCN 2 + 3H 2 O = CaCO 3 + 2NH 3
Печь для получения цианамида кальция представляет собой цилиндр из огнеупорного материала, по оси которого проходит труба, имеющая внутри нагревательную обмотку. После загрузки печи измельченным СаС 2 она наглухо закрывается и в нее подается азот. Так как образование цианамида сопровождается выделением тепла, исходную смесь достаточно нагреть до 800°С, а дальше реакция идет сама. За время с 1913 г. по 1938 г. ежегодная мировая продукция связанного азота по цианамидному методу возросла с 38 тыс. т до 300 тыс. т.
Молекула NH 3 имеет форму треугольной пирамиды. Так как электроны связей Н-N довольно сильно смещены от водорода к азоту (pNH = 0,28), молекула аммиака в целом характеризуется значительной полярностью (длина диполя 0,31 А).
Аммиак представляет собой бесцветный газ (т. пл. -78°С, т. кип. -33°С) с характерным резким запахом «нашатырного спирта». Растворимость его в воде больше, чем всех других газов: один объем воды поглощает при 0°С около 1200, а при 20°С - около 700 объемов NH 3 . Продажный концентрированный раствор имеет, обычно плотность 0,91 и содержит 25% NH 3 по весу.
Подобно воде, жидкий аммиак ассоциирован главным образом за счет образования водородных связей. Он является хорошим растворителем для многих неорганических и органических соединений.
С ассоциацией жидкого аммиака связана его большая теплота испарения (5,6 ккал / моль). Так как критическая температура NH 3 лежит высоко (+ 133°С) и при испарении его от окружающей среды отнимается много тепла, жидкий аммиак может служить хорошим рабочим веществом холодильных машин. При движении поршня направо, нагревшийся от сжатия NH 3 поступает в змеевик, охлаждаемый снаружи водой (или воздухом). Охлажденный аммиак уже при имеющемся в системе давлении (7-8 ат) сжимается и стекает в приемник, из которого жидкий аммиак поступает в змеевик, где испаряется вследствие разрежения в этой части системы. Необходимое для испарения тепло поглощается при этом из окружающего змеевик пространства. Последовательное повторение всего цикла процессов создает непрерывное охлаждение окружающего змеевик пространства.
Для химической характеристики аммиака основное значение имеют реакции трех типов присоединения, замещения водорода и окисления.
Наиболее характерны для аммиака реакции присоединения. В частности, при действии его на многие соли образуются кристаллические аммиакаты состава CaCl 2 ·8NH 3 , CuSO 4 · 4NH 3 и т.п., по характеру образования и устойчивости похожие на кристаллогидраты.
При растворении аммиака в воде происходит частичное образование гидроокиси аммония:
NH 3 + Н 2 О < = >NH 4 OH
В этом соединении радикал аммоний (NH 4) играет роль одновалентного металла. Поэтому электролитическая диссоциация NH 4 OH протекает по основному типу:
NH 4 OH < = >NH 4 + + ОН -
Объединяя оба уравнения, получаем общее представление о равновесиях, имеющих место в водном растворе аммиака:
NH 3 + Н 2 О < = >NH 4 OH < = >NH 4 + + ОН -
Из-за наличия этих равновесий водный раствор аммиака (часто называемый просто «аммиаком») резко пахнет им. Ввиду того что ионов ОН - этот раствор содержит сравнительно немного, NH 4 OH рассматривается как слабое основание.
Добавление кислот ведет к смещению приведенных выше равновесий вправо (ввиду связывания ионов ОН") и к образованию солей аммония, например, по уравнению:
NH 4 OH + HCl = Н 2 О + NH 4 Cl
Соли эти образуются также при непосредственном взаимодействии аммиака с кислотами, например, по реакции:
NH3 + HCl = NH4Cl
Как сам ион аммония (NH 4 +), так и большинство его солей бесцветны. Почти все они хорошо растворимы в воде и в растворах сильно диссоциированы.
При нагревании солей аммония они довольно легко разлагаются. Характер разложения определяется свойствами образующей анион кислоты. Если последняя является окислителем, происходит окисление аммиака по реакции, например:
NH 4 NO 2 = 2H 2 O + N 2
Если кислота окислителем не является, характер распада определяется ее летучестью при температуре разложения. Из солей нелетучих кислот (например, Н 3 РО 4) выделяется только аммиак, если же кислота летуча (например, НСl), то при охлаждении она вновь соединяется с NH 3 . Результат подобного распада и последующего обратного соединения практически сводится к тому, что рассматриваемая соль (например, NH 4 Cl) возгоняется.
Под действием на соли аммония: ильных щелочей происходит выделение аммиака по реакции, например:
NH 4 Cl + NaOH = NaCl + NH 4 OH = NaCl + NH 3 + H 2 O
Этим можно пользоваться для лабораторного получения аммиака, а также для открытия ионов NH·в растворе: к последнему добавляют щелочи и затем обнаруживают выделяющийся аммиак по запаху или действию его на влажную лакмусовую бумажку.
Производные аммония имеют большое практическое значение. Его гидроокись (NH 4 ОH) является одним из важнейших химических реактивов, разбавленные растворы которого («нашатырный спирт») иногда применяются также в домашнем хозяйстве (при стирке белья и выводе пятен). Хлористый аммоний («нашатырь») при высоких температурах реагирует с окислами металлов, обнажая чистую металлическую поверхность. На этом основано использование его при пайке металлов. В электротехнике NH 4 Cl употребляют для изготовления «сухих» гальванических элементов. Азотнокислый аммоний (NH 4 NO 3) является основой сложных азотных удобрений и служит также для приготовления некоторых взрывчатых смесей. Сернокислый аммоний [(NH 4) 2 SO 4 ] в больших количествах потребляется сельским хозяйством как азотное удобрение. Кислый углекислый аммоний (NH 4 HCO 3) применяется при хлебопечении (главным образом в кондитерском производстве). Такое его использование основано на том, что при нагревании он легко разлагается по схеме
NH 4 HCO 3 = NH 3 ^ + H 2 O + CO 2 ^
и образующиеся газы придают тесту необходимую пористость. Сернистый аммоний [(NH 4) SO 4 ] является одним из основных реактивов аналитической химии. Соединения аммония играют важную роль при некоторых производственных процессах химической промышленности и широко используются в лабораторной практике.
Продажный нашатырный спирт содержит обычно около 10% аммиака. Он находит и медицинское применение. В частности, вдыхание его паров или прием внутрь (3-10 капель на рюмку воды) используется для снятия состояния сильного опьянения. Смазывание кожи нашатырным спиртом ослабляет действие укусов насекомых. При выводе пятен хорошие результаты дают во многих случаях следующие составы (по объему):
- а) 4 ч. нашатырного спирта, 5 ч. эфира и 7 ч. винного спирта;
- б) 10 ч. нашатырного спирта, 7 ч. винного спирта, 3 ч. хлороформа и 80 ч. бензина.
Взрывной распад азотнокислого аммония протекает в основном по уравнению:
2NH 4 NO 3 = 4H 2 O + O 2 + 57 ккал
Иногда применяемый в практике взрывных работ аммонал представляет собой тесную смесь NH 4 NO 3 (72%), алюминия в порошке (25%) и угля (3%). Смесь эта взрывается только от детонации.
Реакции замещения водорода менее характерны для аммиака, чем рассмотренные выше реакции присоединения. Однако при высоких температурах он способен замещать свои водороды на металл, например, по реакции:
2Аl+2NH 3 = 2AlN + ЗН 2
Именно накаливанием металлов в атмосфере аммиака чаще всего и получают нитриды. Последние представляют собой твердые вещества, большей частью очень устойчивые по отношению к нагреванию. Водой нитриды активных металлов более или менее легко разлагаются с выделением аммиака, например, по схеме:
Mg 3 N 2 + 6Н 2 О = 3Mg(OH) 2 + 2NH 3 ^
Нитриды малоактивных металлов по отношению к воде, как правило, весьма устойчивы.
Ввиду нелетучести нитридов и нерастворимости их ни в одном из известных растворителей применимых к ним методов определения молекулярных весов пока не существует. Поэтому известны только простейшие формулы нитридов. Во многих из них видимая валентность металла совместима с ее обычными значениями. В других случаях уже сама простейшая формула указывает на сложность молекулярной структуры. К первому типу относится, например, Mn 3 N 2 , ко второму - Cr 2 N.
При замещении в молекуле аммиака только двух атомов водорода получаются имиды, а при замещении лишь одного - амиды металлов. Первые содержат в своем составе двухвалентный радикал = NH (имино-группу), вторые - одновалентный радикал - NH 2 (амино-группу). Например, при пропускании сухого NH 3 над нагретым металлическим натрием по реакции
2Na + 2NH 3 = 2NaNH 2 + Н 2
образуется бесцветный амид натрия, являющийся типичной солью с анионом NH 2 . Водой он разлагается по уравнению:
NaNH 2 + Н 2 О = NH 3 + NaOH
Амид натрия находит применение при органических синтезах.
Наряду с производными металлов известны продукты замещения водородов аммиака на галоид. Примером может служить хлористый азот (NCl 3), образующийся в виде желтых маслянистых капель при действии хлора на крепкий раствор хлористого аммония:
NH 4 Cl + 3Cl 2 = 4HCl + NCl 3
Пары NCl 3 (т. пл. -27°С, т. кип. 71°С) обладают резким запахом. Уже при нагревании выше 90°С (или ударе) хлористый азот с сильным взрывом распадается на элементы.
При действии йода на крепкий раствор NH 3 выделяется темно-коричневый осадок так называемого йодистого азота, представляющего собой смесь NJ 3 с NHJ 2 и NH 2 J. Йодистый азот крайне неустойчив и в сухом виде взрывается от малейшего прикосновения.
Продуктом замещения одного из водородов аммиака на гидроксильную группу является гидроксиламин (NH 2 OH). Он образуется при электролизе азотной кислоты (с ртутным или свинцовым катодом) в результате восстановления HNO 3 по схеме:
НNO 3 + 6Н = > 2Н 2 О + NH 2 OH
Гидроксиламин представляет собой бесцветные кристаллы. Используется он главным образом как восстановитель.
С кислотами гидроксиламин (т. пл. 33°С) дает соли, из которых хлористая (NH 2 OH·НСl) является его обычным продажным препаратом. Все соединения гидроксиламина ядовиты и, как правило, хорошо растворимы в воде. Окислители переводят гидроксиламин либо в N 2 , либо в N 2 O, например, по реакциям:
- 2NH 2 OH + HOCl = N 2 +HCl + 3H 2 O
- 6NH 2 OH + 4HNO 3 = 3N 2 O + 4NO + 11H 2 O.
Подобно замещению водорода, реакции окисления для аммиака сравнительно малохарактерны. На воздухе он не горит, но подожженный в атмосфере кислорода сгорает по уравнению:
4NH 3 + ЗО 2 = 6Н 2 О + 2N 2
Хлор и бром энергично реагируют с аммиаком по схеме:
2NH 3 + ЗГ 2 = 6НГ + N 2
Так же окисляют они аммиак и в растворе. По отношению к большинству других окислителей NH 3 при обычных условиях устойчив. Наиболее важным продуктом частичного окисления аммиака является гидразин (N 2 H 4), образующийся по реакции:
2NH 3 + NaOCl = H 2 O + N 2 H 4 + NaCl
Как видно из уравнения, под действием окислителя каждая молекула аммиака теряет в данном случае один атом водорода, причем остающиеся радикалы NH 2 соединяются друг с другом. Структурная формула гидразина будет, следовательно, H 2 N-NH 2 .
Гидразин представляет собой бесцветную жидкость, смешивающуюся с водой в любых соотношениях. Он находит применение в качестве восстановителя.
Присоединяя кислоты, гидразин (т. пл. 2°С, т. кип. 114°С) образует два ряда солей, например N 2 H 4 ·НСl и N 2 H 4 ·2НСl. Окисляется он обычно до свободного азота (например, по реакции:
2K 2 Cr 2 O 7 + 3N 2 H 4 +8H 2 SO 4 = 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 3N 2 + 14H 2 O)
Пары гидразина в смеси с воздухом способны сгорать по реакции
N 2 H 4 + O 2 = > 2H 2 O + N 2 + 149 ккал
На этом основано использование в качестве ракетного топлива. Гидразин и все его производные ядовиты.
При взаимодействии гидразина с азотистой кислотой по схеме
N 2 H 4 + HNO 2 = 2H 2 O + HN 3
образуется азотистоводородная кислота (Н-N = N?N), представляющая собой бесцветную летучую жидкость с резким запахом. По силе азотистоводородная кислота близка к уксусной, а по растворимости солей (азидов) похожа на соляную. Подобно самой HN 3 , некоторые азиды при нагревании или ударе сильно взрываются. На этом основано применение азида свинца в качестве детонатора, т.е. вещества, взрыв которого вызывает мгновенное разложение других взрывчатых веществ.
Кислотная функция HN 3 (т. пл. -80°С, т. кип. +36°С) характеризуется значением K = 3 ·10-5. Ее взрывной распад идет по реакции:
2NH 3 = H 2 + 3N 2 + 142 ккал
Безводная азотистоводородная кислота способна взрываться даже просто от сотрясения сосуда. Напротив, в разбавленном водном растворе она при хранении практически не разлагается. Пары HN 3 очень ядовиты, а ее водные растворы вызывают воспаление кожи. Азиды, как правило, бесцветны.
В лабораториях азот можно получать по реакции разложения нитрита аммония:
NH 4 NO 2 > N 2 ^ + 2H 2 O+Q
Реакция экзотермическая, идёт с выделением 80 ккал (335 кДж), поэтому требуется охлаждение сосуда при её протекании (хотя для начала реакции требуется нагревание нитрита аммония).
Практически эту реакцию выполняют, добавляя по каплям насыщенный раствор нитрита натрия в нагретый насыщенный раствор сульфата аммония, при этом образующийся в результате обменной реакции нитрит аммония мгновенно разлагается.
Выделяющийся при этом газ загрязнён аммиаком, оксидом азота (I) и кислородом, от которых его очищают, последовательно пропуская через растворы серной кислоты, сульфата железа (II) и над раскалённой медью. Затем азот осушают.
Ещё один лабораторный способ получения азота - нагревание смеси дихромата калия и сульфата аммония (в соотношении 2:1 по массе). Реакция идёт по уравнениям:
K 2 Cr 2 O 7 + (NH 4) 2 SO 4 = (NH 4) 2 Cr 2 O 7 + K 2 SO 4
(NH 4) 2 Cr 2 O 7 >(t) Cr 2 O 3 + N 2 ^ + 4H 2 O
Самый чистый азот можно получить разложением азидов металлов:
2NaN 3 >(t) 2Na + 3N 2 ^
Так называемый «воздушный», или «атмосферный» азот, то есть смесь азота с благородными газами, получают путём реакции воздуха с раскалённым коксом:
O 2 + 4N 2 + 2C > 2CO + 4N 2
При этом получается так называемый «генераторный», или «воздушный», газ-сырьё для химических синтезов и топливо. При необходимости из него можно выделить азот, поглотив монооксид углерода.
Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Этим методом можно получить и «атмосферный азот». Также широко применяются азотные установки, в которых используется метод адсорбционного и мембранного газоразделения.
Один из лабораторных способов - пропускание аммиака над оксидом меди (II) при температуре ~700°С:
2NH3 + 3CuO > N2^ + 3H2O + 3Cu
Аммиак берут из его насыщенного раствора при нагревании. Количество CuO в 2 раза больше расчётного. Непосредственно перед применением азот очищают от примеси кислорода и аммиака пропусканием над медью и её оксидом (II) (тоже ~700°C), затем сушат концентрированной серной кислотой и сухой щёлочью. Процесс происходит довольно медленно, но он того стоит: газ получается весьма чистый.
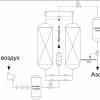
Установка для выработки азота представляет собой комплекс оборудования, с помощью которого азот концентрируется из атмосферного воздуха. Максимальная концентрация азота на выходе составляет 99,9999%. Данный показатель можно корректировать в зависимости от назначения газа.
Адсорбционный генератор
Производство происходит за счет подачи сжатого воздуха под давлением, которое нагнетает винтовой воздушный компрессор. Генератор оснащается системой фильтрации и осушителем. Осушитель воздуха при этом может быть как рефрижераторного типа, так и адсорбционного, в зависимости от назначения и необходимой концентрации азота. В процессе производства сжатый воздух проходит через грубую и тонкую очистку и осушитель, при этом достигается точки росы +3С и класс воздуха соответствует ISO 8573-1:2010-1.4.1. Затем воздух подается после многоступенчатой фильтрации на генератор. На выходе азотное оборудование получаем готовый газ под давлением до 10 бар. Станция состоит из двух колонн, в которых содержится адсорбент для поглощения соответствующего типа газа. Один раз в 8-15 лет требуется замена адсорбента, в зависимости от условий эксплуатации.
Преимущества генераторов азота адсорбционного типа:
- большой ресурс работы;
- быстрый запуск/остановка;
- простота в эксплуатации;
- компактность;
- высокая надежность;
- не требуется контроль оператора во время работы;
- полная автоматизация;
- возможность дистанционного управления через сайт компании Дженерал Газ.
Мембранный генератор
Разделение газов происходит за счет газоразделительной мембраны. Фильтрованный воздух проходит через мембранный модуль. Поток проходит через тысячи селективных волокон. Азот выходит с обратной стороны мембраны, а кислород выходит через ее стенки.
Производство азота предполагает квалифицированную установку всего комплекса оборудования, которое требует соблюдения нормативов безопасности.
Оборудование для производства азота, которое изготавливает компания «Дженерал Газ», имеет в своём составе комплектующие от сертифицированных производителей и проходит тестирование на предмет соответствия высоким стандартам качества и безопасности промышленных агрегатов.
Данное оборудование позволяет добиваться высокой энергоэффективности при производстве азота, который применяется в различных отраслях промышленности:
- электронной;
- пищевой;
- металообрабатывающей;
- фармацевтической;
- металлургической;
- нефтегазовой;
- нефтехимической и химической.
Приобретая оборудование для получения азота в нашей компании, вы получаете выгодные цены, гарантию, быструю поставку и монтаж.
Как выбрать оборудование для получения азота?
Для того чтобы выбрать тип воздухоразделительной установки необходимо разобраться в том какие они бывают:
Для получения технических газов из атмосферного воздуха на данный момент существует три типа воздухоразделительных установок (ВРУ):
- Воздухоразделительные установки криогенного типа.
- Воздухоразделительные установки адсорбционного типа.
- Мембранные воздухоразделительные установки.
ВРУ криогенного типа – это комплекс оборудования осуществляющий последовательную обработку и охлаждение атмосферного воздуха до криогенных температур и последующего разделения путем ректификации на составляющие: кислород, азот, аргон, криптон, ксенон.
Криогенные ВРУ подразделяются:
- Малой = 30 ÷ 300 м³/час;
- Средней = 300 ÷ 3000 м³/час;
- Высокой > 3000 м³/час;
ВРУ адсорбционного типа – это комплекс оборудования, осуществляющий разделения атмосферного воздуха путем пропускания его через молекулярное сито, которое по своей структуре может задерживать молекулы газов. Адсорбционные ВРУ предназначены для получения основных продуктов разделения в газообразном состоянии:
- Кислород;
- Азот.
Производительность адсорбционных установок не ограничена и зависит от числа применяемых модулей, но по концентрации (чистоте) продуктов разделения есть ограничения:
- Концентрация газообразного кислорода на выходе до 98%
- Концентрация газообразного азота на выходе до 99,9995%
Мембранные ВРУ – это комплекс оборудования, осуществляющий разделение сжатого воздуха путем пропускания его через мембранные модули, в которых происходит разделение на основные компоненты: азот и кислород. Мембранные ВРУ предназначены для получения продуктов разделения в газовом состоянии. Производительность мембранных установок зависит от количества применяемых мембранных модулей.
- Концентрация газообразного кислорода на выходе до 90%.
- Концентрация газообразного азота на выходе до 99,5%.
Так же для получения газообразный газов на месте потребления используют криогенные газификаторы, который в свою очередь преобразуют жидкий крио-продукт(азот, кислород или аргон) в газообразное состояние.
В каком случае какую ВРУ применять для получения АЗОТА?
Для того чтобы выбрать ВРУ необходимо знать следующие параметры:
- Потребление газообразного азота м³/час;
- Давление азота, Бар;
- Концентрацию азота, % или остаточная доля кислорода;
- Пиковое потребление, количество «пиков», длительность и периодичность;
- Вариант размещения установки (на улице, в помещении…);
- Существующие коммуникации;
- Удаленность от объекта;
- График работы(потребления);
- Наличие персонала.
Рассмотрим наглядный график:
На графике:
- Поставка в баллонах
- Доставка жидким или в баллонах
- Доставка жидким
- Криогенные ВРУ
Выбор источника азота сложная и требующая внимания задача, от правильности выбора зависит эффективность производственных процессов и себестоимость конечного продукта.
На данный момент рынок адсорбционных азотных генераторов стремительно развивается и в областях где требуется газообразный азот, данный вид генераторов показывает наиболее низкую себестоимость продукционного азота, что составляет ~0,3 кВт на 1 метр кубического азота.
Применяемая технология
Генератор извлекает азот, имеющийся в окружающем воздухе и из других газов, применяя технологию адсорбции с колебаниями давления. Во время процесса адсорбции с колебаниями давления сжатый чистый окружающий воздух подводится к молекулярному ситу, которое позволяет азоту пройти внутрь как получаемый газ, но адсорибрует другие газы. Сито пропускает адсорбированные газы в атмосферу, когда выходной клапан закрыт, а давление фильтрации возвращается к давлению окружающей среды. Затем фильтрующий слой прочищается азотом перед тем, как вводить свежий сжатый воздух для нового цикла производства. Для того, чтобы гарантировать постоянный поток продукта, генераторы азота используют два молекулярных фильтрующих слоя, которые подключаются альтернативно между адсорбционными и регенерирующими фазами. При нормальных рабочих условиях и при правильном обслуживании молекулярные фильтрующие слои имеют почти бессрочный срок службы. Технология адсорбции с колебаниями давления имеет несколько международных патентов и соответствие стандартам рынка по исполнению и эффективности.
Компоновка оборудования
Для того, чтобы генератор азота работал автоматически, необходимы следующие составные компоненты:
Подача сжатого воздуха
Подача определенного количества сжатого воздуха и определенного качества, описанного в разделе предложении. Минимальное количество свободной подачи сжатого воздуха в м 3 /мин при 20°С равно среднему потреблению воздуха генератором азота в Нм 3 /мин, увеличенному на соответствующий процент для компенсации влияния окружающего воздуха и допусков на исполнение воздушного компрессора при расчетных условиях. Система сжатия воздуха будет включена в объем поставки, который будет состоять из воздушного компрессора и рефрижераторной сушилки воздуха.
Воздушные фильтры
Комплект фильтров грубой и высокой степени очистки и активированный угольный фильтр всегда включены в объем поставки. Воздушные фильтры необходимо устанавливать между системой подачи сжатого воздуха и воздушным ресивером, чтобы убедиться, что генератор азота будет получать необходимое минимальное количество.
Воздушный ресивер
Воздушный ресивер устанавливается между воздушными фильтрами и азотным генератором. Принципиальная задача воздушного ресивера - это гарантия подачи достаточного количества свежего воздуха на только что восстановленный фильтрующий слой генератора азота за короткий промежуток времени. Если система сжатого воздуха включена в объем поставки, размеры объема воздушного ресивера будут меняться до удовлетворительных для процесса и сжатия воздуха (макс. нагрузка / циклы без нагрузки).
Ресивер азота
Поток продукции генератора азота собирается в одном ресивере азота. Ресивер азота необходимо установить в непосредственной близости от генератора азота. Наличие ресивера азота гарантирует достаточное противодавление для процесса и постоянного потока азота к конечному заказчику. Если специально не указано, объем ресивера азота рассчитывается на основе предположения о постоянной динамике потребления применением Заказчика в течение продолжительного времени.
Преимущества:
Безопасность
Низкие рабочие давления, безопасное хранение. Нет необходимости в тяжелых газовых баллонах высокого давления. От опасного хранения жидкого азота можно отказаться.
Экономность
Нет расходов на распределение и обработку. Получение азота на месте (пром.площадке) генераторами азота экономит расходы на обработку и хранение в газовых баллонах высокого давления и предотвращает расходы на аренду, транспортировку и потери на испарение у пользователей.
Низкие эксплуатационные расходы.
Предлагаемый процесс имеет более эффективное разделение чем другие системы на рынке. Благодаря этому потребность в подаче воздуха падает, то есть 10 - 25% экономии энергии по сравнению со сравнимыми системами. Благодаря уменьшению вращающихся частей до минимума и использованию высококачественных элементов расходы на обслуживание остаются на низком уровне в течение всего срока службы генератора.
Удобство
Простота установки и обслуживания. У генераторов азота вход воздуха и выход азота находятся на одной стороне. Это означает простую установку, даже при малых углах цеха. Высокая надежность благодаря уменьшенному количеству вращающихся частей и высококачественных компонентов.
Гарантированное качество азота
Отсутствие риска недостаточной чистоты азота, автоматическое возобновление процесса. Генераторы азота обладают уникальной системой контроля: в случае если чистота азота не совпадает с указанным значением, ПЛК автоматически закрывает поток производства азота к выходу применения заказчика и открывают сбросной клапан некондиционного азота. Система будет пробовать запустить процесс, и когда чистота азота достигнет необходимого результата, сбросной клапан закроется, а клапан получения азота снова откроется. Полностью автоматическая и не сопровождаемая оператором процедура, ручной повторный запуск не требуется.
Проектные условия
| Производительность | 1000 нм³/ч (2 x 500 нм³/ч) |
| Содержание остаточного кислорода и производимом газе | £0,1% об. |
| Давление подачи продукта | 5,5 бар изб. |
| Точка росы продукта | £-40 °С при 1 атм. |
| Расход воздуха на входе | 4392,0 нм³/ч (2 x 2196.0 нм³/ч) |
| Макс. уровень шума | 85 дБ (А) на расстоянии 1 метр |
| Планируемые условия окружающей среды | |
| Барометрическое давление | 1013,25 мбар а |
| Высота расположения | 0 м над уровнем моря |
| Температура воздуха | 20 °С |
| Относительная влажность | 65% |
| Потребление воздуха на входе | |
| Давление | |
| Температура | |
| Групповой состав углеводородов | <6,25 мг/м³ или 5 ppmV |
| Частицы | <5 мг/м³ при макс. 3 мкм |
| Точка росы | £+3 °С при 7 бар изб. |
| Условия на площадке | |
| Система электроснабжения | 400 / 230 В переменный ток, 50 Гц |
| Классификация зоны | неклассифицированная зона / безопасная зона |
| размещение | в помещении с хорошей вентиляцией |
Данные приведены для идеального режима работы, допуск ±5%

Размеры, вес
Параметры энергопотребления
Допуск на все указанные значения: ± 10%
Объем поставки
4 воздушных компрессора
- ротационный винтовой компрессор с впрыском масла
4 воздухоосушилки
- рефрижераторный воздухоосушитель
2 воздушных ресивера
- вертикальная емкость высокого давления из углеродистой стали
- объем: 3000 л
фильтры сжатого воздуха
Два комплекта внешних фильтров сжатого воздуха, устанавливаются перед воздушным ресивером, комплект состоит из следующих фильтров:
- один коалесцирующий фильтр первичной очистки (эффективность 99,9999%, 1,0 µ - ≤ 0,5 мг/м³) с устройством для слива конденсата поплавкового типа;
- один коалесцирующий фильтр тонкой очистки (эффективность 99,9999%, 0,01 µ - ≤ 0,1 мг/м³) с устройством для слива конденсата поплавкового типа;
- один активированный угольный фильтр (остаточное масло ≤ 0,005 мг/м³).
два генератора азота
Два азотных генератора, полностью предварительно смонтированы, с установленными проводами на покрашенной раме из углеродистой стали, каждый оснащен следующими компонентами:
- 6 адсорбционных башен, каждая наполнена углеродным молекулярным ситом. Углеродное молекулярное сито будет производства США, Европы или Японии. Изготовленные в Китае или Индии сита не применяются;
- Глушитель отработанного газа, установлен для приглушения отходящего газа до расчетного уровня шума;
- Комплект электро-пневматических технологических клапанов и дросселей, вкл. соленоидные клапаны;
- 1 некондиционный продувочный трубопровод для азота с регулирующим клапаном соленоидного управления;
- Комплект предохранительных клапанов, настроенных на соответствующий уровень давления;
- Все трубопроводы и электрокабели для соединения;
- Локальные датчики давления;
- Одна (1) система контроля для полностью автоматической работы генератора, с полной внутренней проводной обводкой и состоящая из следующих позиций:
- Один ПЛК (Rockwell / Allen Bradley Micro 850 ПЛК) с соединением Ethernet / IP для коммуникации с удаленной системой управления заказчика;
- Один сенсорный графический интерфейс пользователя (Rockwell / Allen Bradley С400), отображающий значения реального времени релевантных параметров и возможные аварийные сообщения для прямой диагностики;
- Все трубопроводы, клапана, контрольно-измерительные приборы и система управления «под ключ», монтированные на раме из углеродистой стали;
- Один (1) автономный анализатор остаточного азота с датчиком из диоксида циркония;
- Один автономный электронный расходомер продукта.
два (2) ресивера азота
- вертикальная емкость высокого давления из углеродистой стали;
- предохранительные клапаны, установленные на соответствующий уровень давления
- объем: 3000 л
- макс рабочее давление: 11,0 бар изб
Применяемые стандарты
- Директива 2009/105/EC для простых сосудов под давлением
- Европейская Директива 97/23/ЕС,EN 13445, EN 13480 по оборудованию, работающему под давлением
- Директива 2004/108/EC по электромагнитной совместимости
- Директива ЕС 2006/95/EC по низковольтному электрооборудованию
- Директива о машинном оборудовании 2006/42/EC
Примечание
При требуемой производительности невозможно модульное исполнение.
Аммиак (NH 3) - соединение азота и водорода. Это лёгкий газ с резким запахом. Получение аммиака в промышленности и лабораториях необходимо для производства удобрений, полимеров, азотной кислоты и других веществ.
В промышленности
Аммиак промышленным путём получают из азота, соединяя его с водородом. Азот берут из воздуха, водород - из воды. Впервые метод разработал немецкий химик Фриц Габер. Промышленный способ получения аммиака стали называть процессом Габера.
Реакция проходит с уменьшением объёма и выделением энергии в виде тепла:
3H 2 + N 2 → 2NH 3 + Q.
Реакция обратима, поэтому необходимо соблюсти несколько условий. При высоком давлении и низких температурах объём полученного аммиака увеличивается. Однако низкие температуры замедляют скорость реакции, а повышение температуры способствует увеличению скорости обратной реакции.
Опытным путём были найдены необходимые условия для проведения реакции:
- температура - 500°C;
- давление - 350 атм;
- катализатор - оксид железа Fe 3 O 4 (магнетит) с примесями оксидов серебра, калия, кальция и других веществ.
При таких условиях получившийся газ содержит 30 % аммиака. Чтобы избежать обратной реакции, вещество быстро охлаждают. При низких температурах получившийся газ превращается в жидкость. Неизрасходованные газы - азот и водород - возвращаются обратно в колонну для синтеза. Такой способ помогает быстро получить большие объёмы аммиака, максимально используя сырьё.

Рис. 1. Получение аммиака промышленным путём.
Чтобы найти нужный катализатор, было испробовано 20 тысяч разных веществ.
В лаборатории
Для получения аммиака в лаборатории используется реакция щелочей на соли аммония:
NH 4 Cl + NaOH → NH 3 + NaCl + H 2 O
Также аммиак лабораторным путём можно получить из хлорида аммония, нагретого вместе с гашёной известью, или разложением гидроксида аммония:
- 2NH 4 Cl + Ca(OH) 2 → CaCl 2 + 2NH 3 + 2H 2 O;
- NH 4 OH ↔ NH 3 + H 2 O.

Рис. 2. Получение аммиака в лаборатории.
Полностью осушить аммиак можно с помощью смеси извести с едким натрием, через которую пропускают полученный газ. Для этой же цели жидкий аммиак смешивают с металлическим натрием и подвергают дистилляции.
Аммиак легче воздуха, поэтому для его сбора пробирку держат вверх дном.
Применение
Аммиак используется в разных отраслях:
- в сельском хозяйстве - для производства азотсодержащих удобрений;
- в промышленности - для производства полимеров, взрывчатых веществ, искусственного льда;
- в химии - для изготовления азотной кислоты, соды;
- в медицине - в качестве нашатырного спирта.

Рис. 3. Производство удобрений.
Что мы узнали?
Аммиак получают промышленным и лабораторным путём. Для получения в промышленных масштабах используется азот и водород. Смешиваясь под высокой температурой, давлением и под действием катализатора, простые вещества образуют аммиак. Чтобы реакция при высокой температуре не пошла в обратную сторону, газ охлаждают. В лаборатории аммиак получают при реакции солей аммония со щелочами, гашёной известью или путём разложения гидроксида аммония. Аммиак применяется в химической промышленности, сельском хозяйстве, медицине, химии.
Азот - химический элемент, который известен каждому. Его обозначают буквой N. Он, можно сказать, основа неорганической химии, и поэтому его начинают изучать еще в восьмом классе. В этой статье мы подробно рассмотрим азот, а также его характеристики и свойства.
История открытия элемента
Такие соединения, как аммиак, селитра, азотная кислота, были известны и применялись на практике задолго до получения чистого азота в свободном состоянии.

Во время эксперимента, проведенного в 1772 году, Даниель Резерфорд сжигал фосфор и прочие вещества в колоколе из стекла. Он выяснил, что газ, остающийся после сгорания соединений, не поддерживает горения и дыхания, и назвал его «удушливым воздухом».
В 1787 году Антуан Лавуазье установил, что газы, входящие в состав обычного воздуха, - это простые химические элементы, и предложил название «Азот». Чуть позже (в 1784 г.) физик Генри Кавендиш доказал, что это вещество входит в состав селитры (группы нитратов). Отсюда происходит латинское название азота (от позднелатинского nitrum и греческого gennao), предложенное Ж. А. Шапталем в 1790 году.
К началу XIX века учеными были выяснены химическая инертность элемента в свободном состоянии и его исключительная роль в соединениях с другими веществами. С этого момента «связывание» азота воздуха стало важнейшей технической проблемой химии.
Физические свойства

Азот немного легче воздуха. Его плотность составляет 1,2506 кг/м³ (0 °С, 760 мм рт. ст.), температура плавления - -209,86 °С, кипения - -195,8 °С. Азот с трудом сжижается. Его критическая температура относительно низка (-147,1 °С), при этом критическое давление довольно высоко - 3,39 Мн/м². Плотность в жидком состоянии - 808 кг/м³. В воде этот элемент менее растворим, чем кислород: в 1 м³ (при 0 °С) Н₂О может раствориться 23,3 г N. Этот показатель выше при работе с некоторыми углеводородами.
При нагревании до невысоких температур этот элемент взаимодействует только с активными металлами. Например, с литием, кальцием, магнием. С большинством других веществ азот вступает в реакцию в присутствии катализаторов и/или при высокой температуре.
Хорошо изучены соединения N с О₂ (кислородом) N₂O₅, NO, N₂O₃, N₂O, NO₂. Из них при взаимодействии элементов (t - 4000 °С) образуется оксид NO. Далее в процессе охлаждения он окисляется до NO₂. Оксиды азота образуются в воздухе при прохождении атмосферных разрядов. Их можно получить действием ионизирующих излучений на смесь N с О₂.

При растворении в воде N₂O₃ и N₂O₅ соответственно получаются кислоты HNO₂ и HNO₂, образующие соли - нитраты и нитриты. Азот соединяется с водородом исключительно в присутствии катализаторов и при высокой температуре, образуя NH₃ (аммиак). Кроме того, известны и другие (они довольно многочисленны) соединения N с H₂, к примеру диимид HN = NH, гидразин H₂N-NH₂, октазон N₈H₁₄, кислота HN₃ и другие.
Стоит сказать, что большинство соединений водород + азот выделены исключительно в виде органических производных. Этот элемент не взаимодействует (непосредственно) с галогенами, поэтому все его галогениды получают только косвенным путем. К примеру, NF₃ образуется при взаимодействии аммиака с фтором.
Большинство галогенидов азота - малостойкие соединения, более устойчивы оксигалогениды: NOBr, NO₂F, NOF, NOCl, NO₂Cl. Непосредственного соединения N с серой также не происходит, N₄S₄ получается в процессе реакции аммиак + жидкая сера. Во время взаимодействия раскаленного кокса с N образуется циан (CN)₂. В процессе нагревания ацетилена С₂Н₂ с азотом до 1500 °С можно получить цианистый водород HCN. При взаимодействии N с металлами при относительно высоких температурах образуются нитриды (к примеру, Mg₃N₂).
При воздействии на обычный азот электроразрядов [при давлении 130–270 н/м² (соответствует 1–2 мм рт. cт.)] и при разложении Mg₃N₂, BN, TiNx и Ca₃N₂, а также при электроразрядах в воздухе может быть образован активный азот, обладающий повышенным запасом энергии. Он, в отличие от молекулярного, весьма энергично взаимодействует с водородом, парами серы, кислородом, некоторыми металлами и фосфором.
Азот входит в состав довольно многих важнейших органических соединений, в том числе - аминокислот, аминов, нитросоединений и прочих.
Получение азота
В лаборатории этот элемент может быть легко получен в процессе нагревания концентрированного раствора нитрита аммония (формула: NH₄NO₂ = N₂ + 2H₂O). Технический метод получения N основан на разделении заранее сжиженного воздуха, который в дальнейшем подвергается разгонке.
Область применения

Основная часть получаемого свободного азота используется при промышленном производстве аммиака, который потом в довольно больших количествах перерабатывается на удобрения, взрывчатые вещества и т. п.
Кроме прямого синтеза NH₃ из элементов, применяется разработанный в начале прошлого века цианамидный метод. Он основан на том, что при t = 1000 °С карбид кальция (образованный накаливанием смеси угля и извести в электропечи) реагирует со свободным азотом (формула: СаС₂ + N₂ = CaCN₂ + С). Полученный цианамид кальция под действием разогретого водяного пара разлагается на CaCO₃ и 2NH₃.
В свободном виде данный элемент применяется во многих отраслях промышленности: в качестве инертной среды при разнообразных металлургических и химических процессах, при перекачке горючих жидкостей, для заполнения пространства в ртутных термометрах и т. д. В жидком состоянии он используется в различных холодильных установках. Его транспортируют и хранят в стальных сосудах Дьюара, а сжатый газ - в баллонах.
Широко применяют и многие соединения азота. Их производство стало усиленно развиваться после Первой мировой войны и на данный момент достигло поистине огромных масштабов.

Это вещество является одним из основных биогенных элементов и входит в состав важнейших элементов живых клеток - нуклеиновых кислот и белков. Однако количество азота в живых организмах невелико (примерно 1–3 % на сухую массу). Имеющийся в атмосфере молекулярный материал усваивают лишь сине-зеленые водоросли и некоторые микроорганизмы.
Довольно большие запасы этого вещества сосредоточены в почве в виде различных минеральных (нитраты, аммонийные соли) и органических соединений (в составе нуклеиновых кислот, белков и продуктов их распада, включая еще не полностью разложившиеся остатки флоры и фауны).
Растения отлично усваивают азот из грунта в виде органических и неорганических соединений. В природных условиях большое значение имеют особые почвенные микроорганизмы (аммонификаторы), которые способны минерализировать органический N почвы до солей аммония.
Нитратный азот грунта образуется в процессе жизнедеятельности нитрифицирующих бактерий, открытых С. Виноградским в 1890 году. Они окисляют аммонийные соли и аммиак до нитратов. Часть усвояемого флорой и фауной вещества теряется из-за воздействия денитрифицирующих бактерий.
Микроорганизмы и растения отлично усваивают как нитратный, так и аммонийный N. Они активно превращают неорганический материал в различные органические соединения - аминокислоты и амиды (глутамин и аспарагин). Последние входят в состав многих белков микроорганизмов, растений и животных. Синтез аспарагина и глутамина путем амидирования (ферментативного) аспарагиновой и глутаминовой кислот осуществляется многими представителями флоры и фауны.
Производство аминокислот происходит при помощи восстановительного аминирования ряда кетокислот и альдегидокислот, возникающих путем ферментативного переаминирования, а также в результате окисления различных углеводов. Конечными продуктами усвоения аммиака (NH₃) растениями и микроорганизмами являются белки, которые входят в состав ядра клеток, протоплазмы, а также откладываются в виде так называемых запасных белков.
Человек и большинство животных могут синтезировать аминокислоты лишь в довольно ограниченной мере. Они не способны производить восемь незаменимых соединений (лизин, валин, фенилаланин, триптофан, изолейцин, лейцин, метионин, треонин), и потому для них главным источником азота являются потребляемые с пищей белки, то есть, в конечном счете, - собственные белки микроорганизмов и растений.