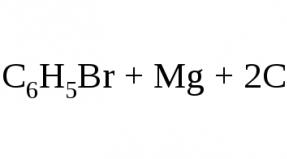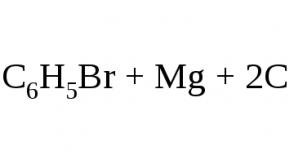Простые эфиры в природе. Простые эфиры: строение, номенклатура, изомерия, методы получения и химические свойства. Лабораторные способы получения эфиров
Простые эфиры – нейтральные и малоактивные соединения, в связи с чем их часто используют в различных органических реакциях в качестве растворителей. Поскольку они в большинстве случаев не реагируют с натрием, то этот металл используют для сушки простых эфиров. На них не действуют разбавленные минеральные кислоты, щелочи. Эфиры не расщепляются металлорганическими соединениями, гидридами и амидами щелочных металлов. Немногие химические свойства этих соединений связаны с наличием свободной электронной пары у атома кислорода, что придает эфирам основные свойства, а также с наличием полярных связей С–О, разрыв одной из которых приводит к расщеплению простых эфиров.
Образование солей оксония. Несмотря на то, что эфиры являются слабыми основаниями и плохими нуклеофилами. Они способны взаимодействовать с сухим хлороводородом с образованием солей диалкилгидроксония.
(C 2 H 5) 2 O + HCl → (C 2 H 5) 2 OH + Cl
Образовавшаяся оксониевая соль, как соль слабого основания, роль которого играет молекула эфира, легко гидролизуется при разбавлении водой.
(С 2 Н 5) 2 ОН + Сl + H 2 O → (C 2 H 5) 2 O + HCl
Об основном характере эфиров свидетельствует их растворимость в концентрированной серной кислоте и выделение при низкой температуре кристаллической оксониевой соли.
Эту реакцию применяют для отделения простых эфиров от алканов и галогеналканов.
В 1928 г. Х. Мейервейн открыл третичные оксониевые соли , которые можно получить из эфиров в результате следующей реакции:
Роль галогенидов бора состоит в отщеплении галогена от галогеналкана и связывании его в прочный анион. Триалкилоксониевые соединения с комплексными анионами – твердые, вполне устойчивые солеобразные соединения. При попытке заменить анион в этих солях на анионы какой-либо обычной кислоты, т.е. при взаимодействии их с кислотами, солями и даже с водой, оксониевые соли распадаются с образованием простого эфира и алкилированного аниона. Триалкилоксониевые соли являются самыми сильными алкилирующими средствами (сильнее галогеналканов и диалкилсульфатов).
Эфир используют в качестве растворителя в реакции Гриньяра , т.к. он обладает способностью сольватировать и, таким образом, растворять реагент. Он выступает как основание по отношению к кислому атому магния.

Диэтиловый эфир в этой реакции можно заменить на тетрагидрофуран.
Реактивы Гриньяра можно получить с хорошим выходом в бензоле в присутствии триэтиламина в качестве основания; требуется один моль основания на один моль галогеналкана.
Как основания Льюиса простые эфиры образуют комплексы , в которых эфир играет роль донора электронов, а галоген – акцептора. Так, раствор иода в диэтиловом эфире окрашен в коричневый цвет, в отличие от фиолетовой окраски в инертных растворах. Такие комплексы получили название комплексов с переносом заряда (КПЗ).

Расщепление простых эфиров . Простые эфиры при нагревании до 140 ºС с концентрированными кислотами (H 2 SO 4 , HBr и, особенно, HI) способны подвергаться расщеплению. Эта реакция была открыта А. Бутлеровым в 1861 г. на примере 2-этоксипропановой кислоты.

Под воздействием иодоводородной кислоты эфир первоначально превращается в иодид диалкилгидроксония. Это приводит к увеличению полярности связей С–О и облегчению гетеролитического расщепления одной из них с образованием хорошей уходящей группы – молекулы спирта. Роль нуклеофила выполняет иодид-ион:
При расщеплении метил- и этилалкиловых эфиров действие нуклеофила направлено на более пространственно доступный метильный или этильный радикал. На этой особенности основан количественный метод Цейзеля – определение метокси- и этоксигрупп в органических соединениях.
Следует отметить, что если один из алкилов третичный, то расщепление идет особенно легко.
Реакция протонированного эфира с ионом галогена, так же как соответствующая реакция протонированного спирта, может протекать как по S N 1, так и S N 2-механизмам в зависимости от строения эфира. Как и следовало ожидать, первичная алкильная группа имеет тенденцию к S N 2, в то время как третичная – к S N 1-замещению:

Реакции по -водородному атому . Наличие в эфирах атома кислорода сказывается на поведении атомов водородов, особенно находящихся в α-положении. Такая региоселективность объясняется стабильностью радикала R-ĊH-Ö-R, где неспаренный электрон 2р -орбитали углерода перекрывается с неподеленной парой 2р -электронов атома кислорода.
Наиболее эффективно и избирательно протекают свободнорадикальные реакции хлорирования. Так, при обработке диэтилового эфира рассчитанным количеством хлора на свету образуется α-монохлорид.
Скорость реакций α-хлорзамещенных эфиров на много порядков выше по сравнению с соответствующими галогеналканами. Они чрезвычайно легко вступают в реакции нуклеофильного замещения, особенно протекающие через образование устойчивого промежуточного карбокатиона, т.е. по механизму S N 1. Эта устойчивость отражается резонансными структурами:
Подобные реакции широко используют в органическом синтезе.
Примечательно, что, меняя условия проведения реакции, ее можно направить по пути дегидрогалогенирования с получением простых виниловых эфиров.
Реакции аутоокисления . Простые эфиры склонны к реакциям аутоокисления кислородом по радикальному механизму даже без облучения, что объясняется устойчивостью образующегося свободного радикала за счет делокализации неспаренного электрона углерода с электронной парой соседнего атома кислорода:

Особенно легко подвергаются аутоокислению эфиры, содержащие атом водорода у третичного углерода. Спонтанно образующиеся при стоянии гидропероксиды эфиров исключительно взрывоопасны. Будучи менее летучими, по сравнению с исходными эфирами, они не отгоняются вместе с эфирами, а накапливаются в колбе. По этой причине эфиры нельзя отгонять досуха, т. к. в противном случае может произойти взрыв. Гидропероксиды должны быть тщательно удалены из эфира с помощью восстановителей – солей железа(II) или олова(II).
Тестом на наличие пероксидов является обработка пробы эфира водным раствором иодида калия. Появление характерного коричневого окрашивания, а в присутствии крахмала – синего цвета указывают на присутствие гидропероксидов.
Простыми эфирами (этерами) называют соединения общей формулы ROR". По номенклатуре ИЮПАК эфиры рассматриваются как алкоксиалканы. При этом больший радикал считается основным. Для простых эфиров чаще, чем для других классов соединений, применяется радикально-функциональная номенклатура. В этом случае названия образуют из названий радикалов R и R’, связанных с атомом кислорода, добавляя слово "эфир":
илиэтоксиэтан 2-метокси-2-метилпропан
(диэтиловый эфир) (трет -бутилметиловый эфир, ТБМЭ)
Хорошими протонными растворителями для проведения реакций являются целлозольв и метилцеллозольв. Хорошим растворителем для поведения реакций гидроборирования и для восстановления гидроборатом натрия является диглим.
2-метоксиэтанол 2-этоксиэтанол диэтиленгликольдиэтиловый эфир
(метилцеллозольв) (целлозольв) (диглим)
Широкое применение находят циклические эфиры:
окись этилена тетрагидрофуран тетрагидропиран 1,4-диоксан
Простые эфиры имеют ту же геометрию, что и Н 2 О (Гиллеспи). Валентный угол С-О-С соответстввует 112 о для СН 3 ОСН 3 , что близко к тетраэдрическому углу и указывает на sp 3 -гибридизацию атома кислорода.
Молекулы простых эфиров не могут образовывать водородные связи между собой, и поэтому они значительно более летучи, чем спирты с тем же числом атомов углерода. Плотность эфиров меньше, чем воды. Их растворимость в воде, с которой они могут образовывать водородные связи почти такая же как и у изомерных им спиртов, например, диэтиловый эфир и 1-бутанол растворяются в воде в количестве примерно 8 г на 100 мл воды.
Эфиры химически довольно инертны и поэтому широко используются в качестве растворителей. Многие эфиры имеют приятный запах и испозьзуются в парфюмерии.
Упр.1. Изобразите каркасные формулы и назовите по ИЮПАК и общепринятыми названиями следующие эфиры:
(б) (в)
(в) 
Ответ:
(а) 2-метокси-2-метилпропани (трет -бутилметиловый эфир), (б) 2-метокси-2-метилпропани (трет -бутилэтиловый эфир), (в) транс -2-этоксициклогексанол, (г) метоксиэтен (винилметиловый эфир).
1. Получение простых эфиров
Существует три общих метода получения простых эфиров: межмолекулярная дегидратация спиртов, взаимодействие спиртов с алкенамии и реакция Вильямсона.
1.1. Межмолекулярная дегидратацией спиртов
В присутствии концентрированной серной кислоты, безводной фосфорной кислоты или таких катализаторов, как оксид или фосфат алюминия от двух молекул спирта отщепляется вода:
(1)диэтиловыйи эфир
Механизм S N 2:
этилгидроксоний (М 1)

Диэтилгидроксоний
Способ пригоден для получения симметричных простых эфиров из неразветвленных первичных спиртов:
(2)b-бромэтиловый спирт b-дибромэтилового эфиров
Дегидратация 1,4-бутандиола в присутствии фосфорной кислоты приводит к образованию циклического эфира тетрагидрофурана (ТГФ):
 (3)
(3)
1,4-бутандиол тетрагидрофуран (ТГФ)
Рассмотренный метод пригоден лишь для получения симметричных простых эфиров из неразветвленных первичных спиртов, за исключением такого случая, когда один спирт третичный, а второй _ первичный:
(4)трет -бутанол 1-бутанол бутил-трет -бутиловый эфир
В промышленности межмолекулярной дегидратацией спиртов получают диэтиловый, дибутиловый и ряд других простейших эфиров.
Упр.2. Опишите механизм реакции:
Ответ:

Упр.3. Напишите реакции получения (а) диэтилового, (б) дибутилового и (в) b-дибромэтилового эфиров и (г) тетрагидрофурана (ТГФ) и опишите их механизм.
1.2. Синтез эфиров по реакции Вильямсона
Эта реакция рассматривалась ранее при изучении алкилгалогенидов.

Алкоголяты металлов легко вступают в реакции нуклеофильного замещения, предоставляя алкоксид-анионы RO - . В случае необходимости получения асимметричных эфиров нужно тщательно рассматривать возможность использования галогенуглеводородов и алкоголятов спиртов.
 (5)
(5)
2-метоксипропан
(6)бензил-трет -бутиловый эфир
При синтезе алкилариловых эфиров необходимо на фенолят действовать алкилгалогенидом, поскольку арилгалогениды не реагируют с алкоголятами.
Упр.4. Напищите реакции получения следующих эфиров:
 (б)
(б) Упр.5. Из каких соединений по Вильямсону можно получить
(а) метилизопропиловый эфир, (б) трет- бутилэтиловый эфир
(в) пропилфениловый эфир? Объясните выбор реагентов.
1.3. Присоединение спиртов к алкенам
В присутствии кислоты спирты присоединяются к алкенами с образованием эфиров. Механизм реакции напоминает механизм гидратации алкенов.
 (7)
(7)
трет- бутилметиловый эфир
Механизм:
 (М 2)
(М 2)


Этот метод часто используется для защиты гидроксильной группы первичных спиртов при проведении реакций с другими функциональными группами этой же молекулы, т.к. трет -бутильная группа легко может быть снята при действии кислоты.
Упр.6. Имея в своем распоряжении 3-бром-1-пропанол и ацетиленид натрия, предложите схему получения сначала 4-пентин-1-ола, а затем
Простые эфиры имеют общую формулу . Все эфиры, указанные в табл. 19.5, за исключением феноксибензола, при нормальных условиях представляют собой газы или летучие жидкости. Их температуры кипения имеют приблизительно такие же значения, как и у алканов с близкими относительными молекулярными массами. Однако поскольку молекулы эфиров не ассоциированы путем образования между ними водородных связей, эфиры имеют намного более низкие температуры кипения по сравнению с изомерными им спиртами (табл. 19.6).
Таблица 19.5. Примеры простых эфиров

Таблица 19.6. Температуры кипения алкана, эфира и спирта с близкими значениями относительной молекулярной массы

Лабораторные способы получения эфиров
Симметричные эфиры, как, например, этоксиэтан (диэтиловый эфир) могут быть получены путем частичной дегидратации спиртов с помощью концентрированной серной кислоты в условиях избыточного количества спирта:
Дегидратация спиртов обсуждалась выше.
Как симметричные эфиры, например этоксиэтан, так и несимметричные эфиры, например метоксиэтан (метилэтиловый эфир) и этоксибензол (этил-фениловый эфир) могут быть получены из соответствующих галогеноалканов и спиртов с помощью синтеза Вильямсона (см. выше).
Химические свойства простых эфиров
Эфиры обладают намного меньшей реакционной способностью, чем спирты. Поскольку к атому кислорода в эфирах не присоединен атом водорода, эфиры не обладают кислотными свойствами, которые присущи спиртам. Например, они не взаимодействуют с натрием. Однако эфиры проявляют слабоосновные свойства, которые обусловлены наличием неподеленных пар электронов на атоме кислорода.
Алифатические эфиры ведут себя в кислой среде как основания Льюиса. Они растворяются в сильных минеральных кислотах, образуя дизамещенные соли гидроксония:

При нагревании алифатических эфиров в смеси с концентрированной иодоводородной кислотой происходит образование иодоалканов:
Например, реакция этоксиэтана с иодоводородной кислотой приводит к образованию дометана.
Если группы R и R" в простом эфире одинаковы, то его называют симметричным, если разные несимметричным. В название эфира включают названия органических групп, упоминая их в алфавитном порядке, и добавляют слово эфир, например, C 2 H 5 OC 3 H 7 пропилэтиловый эфир. Для симметричных эфиров перед названием органической группы вводят приставку «ди», например, C 2 H 5 OC 2 H 5 диэтиловый эфир. Для многих эфиров часто используют тривиальные (упрощенные) названия, сложившиеся исторически. К простым эфирам иногда относят соединения, которые содержат эфирный фрагмент СОС в составе циклической молекулы (рис. 1), одновременно их причисляют к другому классу соединений гетероциклическим соединениям. Есть также соединения (см. АЛЬДЕГИДЫ И КЕТОНЫ), в состав которых входит фрагмент СОС, но к классу эфиров их не относят, это полуацетали соединения, содержащие одновременно алкокси- и гидрокси-группу у одного атома углерода: >C(OH)OR, а также ацетали соединения, где у одного атома углерода находятся одновременно две RО-группы: >C(OR) 2 (рис. 1). Наличие у одного атома углерода сразу двух химически связанных атомов О делает эти соединения непохожими по химическим свойствам на простые эфиры.
Рис. 1. ПРОСТЫЕ ЭФИРЫ , содержащие эфирный фрагмент в составе циклической молекулы (чаще такие соединения относят к гетероциклическим), а также полуацетали и ацетали, содержащие эфирный фрагмент, но не относящиеся к классу простых эфиров.
Химические свойства простых эфиров.
Простые эфиры представляют собой бесцветные жидкости с характерным (так называемым эфирным) запахом, практически не смешиваются с водой и неограниченно смешиваются с большинством органических растворителей. В сравнении со спиртами и альдегидами простые эфиры химически менее активны, например, они устойчивы к действию щелочей и щелочных металлов (металлический Na применяют даже для удаления следов воды из эфиров). В отличие от щелочей, кислоты расщепляют эфирный фрагмент, для этого чаще применяют галоидоводороды, особенно эффективен HI. При комнатной температуре образуется и спирт, и йодистый алкил (рис. 2А), а при нагревании йодистый алкил и вода (рис.2А), т.е. реакция протекает более глубоко. Простые эфиры, содержащие ароматические циклы, более устойчивы к расщеплению, для них возможна только стадия, аналогичная А, образуется фенол, а йод к ароматическому ядру не присоединяется (рис. 2В).
Рис. 2. РАСЩЕПЛЕНИЕ ЭФИРНОГО ФРАГМЕНТА при действии HI
Атом кислорода в эфирном фрагменте содержит свободную электронную пару СÖC , благодаря этому эфиры оказываются способными присоединять различные нейтральные молекулы, склонные к образованию донорно-акцепторных связей, атом кислорода дает для образования связи электронную пару (донор), роль акцептора, принимающего эту пару, играет присоединяющаяся молекула или ион (см . АМИНЫ). В результате возникают комплексные соединения (рис. 3).
Рис. 3. ОБРАЗОВАНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ С УЧАСТИЕМ ПРОСТЫХ ЭФИРОВ
В присутствии кислорода воздуха на свету эфиры частично окисляются с образованием перекисных соединений ROOR", которые способны взрываться даже при слабом нагреве, поэтому, приступая к перегонке эфира, его предварительно обрабатывают восстановителями, разрушающими перекиси, часто вполне достаточно хранить эфир над металлическим Na.
Получение простых эфиров.
Наиболее удобный способ взаимодействие алкоголятов щелочных металлов R"ONa с алкилгалогенидами RHal, таким методом можно получать как симметричные (рис. 4А), так и несимметричные простые эфиры (рис. 4Б). В промышленности симметричные простые эфиры получают дегидратацией (отщеплением воды) спиртов с помощью серной кислоты (рис. 4В), этот метод позволяет получать эфиры, у которых в органической группе R не более 5 атомов С.
Рис. 4. ПОЛУЧЕНИЕ ПРОСТЫХ ЭФИРОВ
Применение простых эфиров
определяется, в основном, тем, что они очень хорошо растворяют многие жиры, смолы и лаки. Наиболее широко используют ДИЭТИЛОВЫЙ ЭФИР (С 2 Н 5) 2 О, техническое название «серный эфир», поскольку его получают в присутствии серной кислоты (рис. 4В). Помимо применения в качестве растворителя, а также в роли реакционной среды при проведении различных органических синтезов его используют и для экстрагирования (извлечения) некоторых органических веществ, например, спиртов, из водных растворов, поскольку сам эфир очень мало растворим в воде. В медицине серный эфир применяют для наркоза.
Диизопропиловый эфир (СН 3) 2 СНОСН(СН 3) 2 используют как растворитель и как добавку к моторному топливу для повышения октанового числа.
Анизол С 6 Н 5 ОСН 3 (рис. 4) и ФЕНЕТОЛ С 6 Н 5 ОС 2 Н 5 (рис. 3) используют в качестве промежуточных продуктов при получении красителей, лекарств и душистых веществ.
Дифениловый эфир (дифенилоксид) (С 6 Н 5) 2 О из-за высокой температуры кипения (259,3° С) и химической устойчивости применяют как теплоноситель. Чтобы при остывании до комнатной температуры он не переходил в твердое состояние (его т. пл. 2829° С), в него добавляют дифенил (С 6 Н 5) 2 . Такая смесь, называемая в технике даутермом, может работать как теплоноситель в широком диапазоне температур.
Диоксан, циклический эфир (СН 2 СН 2 О) 2 (рис.), по химическим свойствам близок обычным простым эфирам, но в отличие от них неограниченно смешивается с водой и большинством органических растворителей. Растворяет жиры, воски, масла, эфиры, целлюлозы, его широко применяют и как реакционную среду при проведении различных органических синтезов.
Михаил Левицкий
Простые эфиры представляют собой органические вещества, в которых молекулы содержат углеводородные радикалы, соединенные атомом кислорода. Записать это можно следующим образом: R"-O-R", где R" и R" являются одинаковыми или различными радикалами.
Простые эфиры рассматриваются в качестве производных спиртов. Эти соединения имеют составные названия. При этом используется название радикалов (по возрастанию молекулярной массы) и, собственно, слово СН3ОСН3, метилэтиловый эфир С2Н5ОСН3 и так далее).
Симметричные соединения R-O-R получаются при межмолекулярной спиртовой дегидратации. В одной молекуле при этом происходит разрыв связи О-Н, а в другой - связи С-О. Реакция может быть рассмотрена в качестве нуклеофильного замещения НО-группы (в одной молекуле) группой RO (из другой молекулы).
Несимметричные соединения R-O-R" формируются при взаимодействии галогеноуглеводорода и алкоголята.
Простые эфиры (в отличие от изомерных им спиртов) обладают более низкими температурами плавления и кипения. С водой соединения почти не смешиваются. Это связано с тем, что простые эфиры не формируют из-за отсутствия в их молекулах полярных связей О-Н.
Соединения являются малоактивными. Они обладают более низкой способностью к реакции, нежели спирты.
Простыми эфирами часто пользуются как растворителями из-за их способности растворять многие органические вещества.
К важнейшим соединениям относят гетероциклические кислотосодержащие вещества: диоксан и эпоксид (этиленоксид).
Первый является хорошим растворителем. Диоксан способен смешиваться как с углеводородами, так и с водой. Благодаря этим качествам это соединение называют еще "органической водой". Диоксан токсичен, однако наибольшую опасность представляют его галогеносодержащие дибензопроизводные.
Эфиры целлюлозы являются продуктами замещения атома водорода в гидроксильных группах макромолекулы целлюлозы алкильными или кислотными остатками. Синтез осуществляется с целью придания новых в частности, термопластичности и растворимости. При замещении кислотными остатками формируются сложные, при замещении алкильными остатками - простые соединения.
Первые получают в процессе ацилирования и этерификации - при взаимодействии целлюлозы с неорганическими и органическими кислотами, их хлорангидридами и ангидридами. Наибольшее практическое значение придается ксатогенатам. Эти соединения получают при взаимодействии с неорганическими кислотами и применяют их при изготовлении целлофана и вискозных волокон. Промышленное значение имеют и нитраты целлюлозы. Их используют при получении лаков, пленок, бездымного пороха.
Из соединений, полученных при взаимодействии с в промышленности широко применяют ацетаты целлюлозы. Их используют при получении пластмасс и пленок.
Существуют также и смешанные целлюлозные эфиры. Они содержат различные ацильные и алкильные заместители.
Свойства всех целлюлозных эфиров зависят от природы радикала. Значение имеет и степень замещения и полимеризации.
Низкозамещенные простые соединения растворяются в водных щелочных растворах и воде. Это позволяет применять их в качестве загустителей и стабилизаторов в эмульсиях в нефтяной, бумажной, текстильной, пищевой, фармацевтической и прочих отраслях промышленности. Высокозамещенные и простые) совместимы с пластификаторами. Их используют в изготовлении пластмасс и получении лаков.
Краун-эфиры являются полиэфирами, содержащими в цикле несколько кислородных атомов. Формально их рассматривают в качестве продуктов циклоолигомеризации этиленовой окиси. Уникальным свойством этих соединений является способность формировать комплексы с солями разных Образуются эти комплексы благодаря электростатическому взаимодействию.