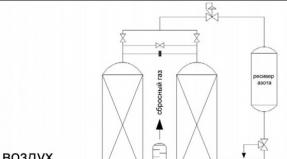
แคลเซียมคาร์บอเนตแต่งแต้มเปลวไฟ คู่มือเคมีทั่วไปและอนินทรีย์ เติมนมมะนาว
โซเดียม– องค์ประกอบของคาบที่ 3 และกลุ่ม IA ของตารางธาตุ เลขลำดับ 11 สูตรอิเล็กทรอนิกส์ของอะตอม [ 10 Ne]3s 1 สถานะออกซิเดชัน +I และ 0 มีอิเล็กโทรเนกาติวีตี้ต่ำ (0.93) จัดแสดงเฉพาะโลหะ (พื้นฐาน) คุณสมบัติ . ก่อตัว (เป็นไอออนบวก) เกลือและสารประกอบไบนารีจำนวนมาก เกลือโซเดียมเกือบทั้งหมดละลายได้ดีในน้ำ
ในธรรมชาติ - ที่ห้าธาตุที่มีความอุดมสมบูรณ์ทางเคมี (รองจากโลหะ) พบเฉพาะในรูปของสารประกอบเท่านั้น สำคัญยิ่ง องค์ประกอบที่สำคัญสำหรับสิ่งมีชีวิตทุกชนิด
โซเดียม โซเดียมไอออนบวก และสารประกอบของโซเดียมจะเพิ่มสีสันให้กับเปลวไฟ เตาแก๊สด้วยสีเหลืองสดใส ( การตรวจสอบเชิงคุณภาพ)
โซเดียม นา โลหะสีเงิน-ขาว เบา นุ่ม (มีดตัดได้) ละลายต่ำ เก็บโซเดียมไว้ในน้ำมันก๊าด ก่อตัวเป็นโลหะผสมเหลวกับปรอท - มัลกัม(สูงถึง 0.2% นา)
โซเดียมที่มีปฏิกิริยาสูงในอากาศชื้นจะค่อยๆ เคลือบด้วยฟิล์มไฮดรอกไซด์และสูญเสียความมันวาว (ทำให้เสื่อมเสีย):
โซเดียมมีฤทธิ์ทางเคมีและเป็นสารรีดิวซ์ที่รุนแรง ติดไฟในอากาศที่อุณหภูมิความร้อนปานกลาง (>250 °C) ทำปฏิกิริยากับอโลหะ:
2Na + O 2 = นา 2 O 2 2Na + H 2 = 2NaH
2Na + Cl 2 = 2NaCl 2Na + S = นา 2 ส
6Na + N 2 = 2Na 3 N 2Na + 2C = นา 2 C 2
พายุมากและยิ่งใหญ่มาก ภายนอก-ผลของโซเดียมทำปฏิกิริยากับน้ำ:
2Na + 2H 2 O = 2NaOH + H 2 ^ + 368 กิโลจูล
จากความร้อนของปฏิกิริยา ชิ้นโซเดียมจะละลายเป็นลูกบอล ซึ่งเริ่มเคลื่อนที่แบบสุ่มเนื่องจากการปลดปล่อย H 2 ปฏิกิริยาจะมาพร้อมกับการคลิกอย่างรวดเร็วเนื่องจากการระเบิดของก๊าซระเบิด (H 2 + O 2) สารละลายเป็นสีแดงเข้มพร้อมฟีนอล์ฟทาลีน (ตัวกลางที่เป็นด่าง)
ในอนุกรมแรงดันไฟฟ้า โซเดียมจะอยู่ทางด้านซ้ายของไฮโดรเจนอย่างมีนัยสำคัญ โดยจะแทนที่ไฮโดรเจนจากกรดเจือจาง HCl และ H 2 SO 4 (เนื่องจาก H 2 O และ H +)
ใบเสร็จโซเดียมในอุตสาหกรรม:
(ดูการเตรียม NaOH ด้านล่างด้วย)
โซเดียมใช้ในการผลิต Na 2 O 2, NaOH, NaH รวมถึงการสังเคราะห์สารอินทรีย์ โซเดียมหลอมเหลวทำหน้าที่เป็นสารหล่อเย็นในเครื่องปฏิกรณ์นิวเคลียร์ และใช้โซเดียมที่เป็นก๊าซเป็นตัวเติมสำหรับโคมไฟกลางแจ้งที่มีแสงสีเหลือง
โซเดียมออกไซด์ Na 2 O. ออกไซด์พื้นฐาน สีขาว มีโครงสร้างไอออนิก (Na +) 2 O 2- มีความเสถียรทางความร้อน สลายตัวช้าๆ เมื่อถูกความร้อน ละลายภายใต้ความดันไอ Na ที่มากเกินไป ไวต่อความชื้นและคาร์บอนไดออกไซด์ในอากาศ ทำปฏิกิริยาอย่างแรงกับน้ำ (เกิดสารละลายที่เป็นด่างแก่), กรด, ออกไซด์ที่เป็นกรดและแอมโฟเทอริก, ออกซิเจน (ภายใต้ความดัน) ใช้สำหรับการสังเคราะห์เกลือโซเดียม ไม่ได้เกิดขึ้นเมื่อโซเดียมถูกเผาในอากาศ
สมการของปฏิกิริยาที่สำคัญที่สุด:

ใบเสร็จ:การสลายตัวทางความร้อนของ Na 2 O 2 (ดู) รวมถึงการหลอมรวมของ Na และ NaOH, Na และ Na 2 O 2:
2Na + 2NaOH = 2Na a O + H 2 (600 °C)
2Na + Na 2 O 2 = 2Na a O (130–200 °C)
โซเดียมเปอร์ออกไซด์นา2O2- การเชื่อมต่อแบบไบนารี สีขาวดูดความชื้น. มีโครงสร้างไอออนิก (Na +) 2 O 2 2- เมื่อถูกความร้อนจะสลายตัวและละลายภายใต้ความดันส่วนเกิน O 2 . ดูดซับคาร์บอนไดออกไซด์จากอากาศ สลายตัวอย่างสมบูรณ์ด้วยน้ำ, กรด (ปล่อย O 2 ออกมาระหว่างการเดือด - ปฏิกิริยาเชิงคุณภาพสำหรับเปอร์ออกไซด์) ตัวออกซิไดซ์ที่แรง, ตัวรีดิวซ์ที่อ่อนแอ ใช้สำหรับการสร้างออกซิเจนใหม่ในอุปกรณ์ช่วยหายใจแบบมีถังอากาศในตัว (ทำปฏิกิริยากับ CO 2) โดยเป็นส่วนประกอบของสารฟอกขาวสำหรับผ้าและกระดาษ สมการของปฏิกิริยาที่สำคัญที่สุด:
2Na 2 O 2 = 2Na 2 O + O 2 (400–675 °C สุญญากาศ)
Na 2 O 2 + 2H 2 O = H 2 O 2 + 2NaOH (ในที่เย็น)
2Na 2 O 2 + 2H 2 O = O 2 ^ + 4NaOH (เดือด)
Na 2 O 2 + 2НCl (เจือจาง) = 2NaCl + Н 2 O 2 (เย็น)
2Na 2 O 2 + 4НCl (เจือจาง) = 4НCl + 2Н 2 O + O 2 ^ (เดือด)
2นา 2 O 2 + 2CO 2 = นา 2 CO 3 + O 2
นา 2 O 2 + CO = นา 2 CO 3
นา 2 O 2 + 4H + + 2I - = ฉัน 2 v + 2H 2 O + 2Na +
5Na 2 O 2 + 16H + + 2MnO 4 - = 5O 2 ^ + 2Mn 2+ + 8H 2 O + 10Na +
3Na 2 O 2 + 2 3- = 2CrO 2 4- + 8OH - + 2H 2 O + 6Na + (80 °C)
ใบเสร็จ:การเผาไหม้ของนาในอากาศ
โซเดียมไฮดรอกไซด์ NaOHไฮดรอกไซด์พื้นฐาน ด่าง ชื่อทางเทคนิค โซเดียมไฮดรอกไซด์ผลึกสีขาวที่มีโครงสร้างไอออนิก (Na +)(OH -) มันละลายในอากาศดูดซับความชื้นและคาร์บอนไดออกไซด์ (เกิด NaHCO 3) ละลายและเดือดโดยไม่สลายตัว ทำให้เกิดแผลไหม้อย่างรุนแรงต่อผิวหนังและดวงตา.
ละลายได้มากในน้ำ (ด้วย ภายนอก-เอฟเฟกต์ +56 กิโลจูล) ทำปฏิกิริยากับกรดออกไซด์ ทำให้กรดเป็นกลาง ทำให้เกิดการทำงานของกรดในแอมโฟเทอริกออกไซด์และไฮดรอกไซด์:

NaOH (เจือจาง) + H 3 PO 4 (เข้มข้น) = NaH 2 PO 4 + H 2 O
2NaOH (ดิล.) + H 3 PO 4 (ดิล.) = นา 2 HPO 4 + 2H 2 O
3NaOH (เข้มข้น) + H 3 PO 4 (เจือจาง) = นา 3 PO 4 + 3H 2 O
2NaOH (T) + M 2 O 3 = 2NaMO 2 + H 2 O (1,000 °C, M = อัล, Cr)
2NaOH (เข้มข้น) + 3H 2 O + AI 2 O 3 = 2Na (เดือด)
2NaOH (T) + M(OH) 2 = นา 2 MO 2 + 2H 2 O (500 °C, M = Be, Zn)
2NaOH (เข้มข้น) + Zn(OH) 2 = นา 2
ตกตะกอนไฮดรอกไซด์ที่ไม่ละลายน้ำ:
2NaOH + MCl 2 = 2NaCl + M(OH) 2 v (M = Mg, Cu)
สลายฮาโลเจนและซัลเฟอร์:
2NaOH (เข้มข้น เย็น) + E 2 = NaE + NaEO + H 2 O (E = Cl, Br)
6NaOH (ดิล., ฮ.) + 3S = 2Na 2 S + นา 2 SO 3 + 3H 2 O
ขึ้นอยู่กับกระแสไฟฟ้าในการหลอมละลาย:
สารละลาย NaOH กัดกร่อนแก้ว (เกิด NaSiO 3) และกัดกร่อนพื้นผิวอะลูมิเนียม (เกิด Na และ H 2)
ใบเสร็จ NaOH เข้า อุตสาหกรรม:
ก) อิเล็กโทรไลซิสของสารละลาย NaCl บนแคโทดเฉื่อย:
b) อิเล็กโทรไลซิสของสารละลาย NaCl บนแคโทดปรอท (วิธีอะมัลกัม):

(สารปรอทที่ปล่อยออกมาจะถูกส่งกลับไปยังเครื่องอิเล็กโตรไลเซอร์)
โซดาไฟเป็นวัตถุดิบที่สำคัญที่สุดของอุตสาหกรรมเคมี ใช้ในการผลิตเกลือโซเดียม เซลลูโลส สบู่ สีย้อม และเส้นใยประดิษฐ์ เป็นเครื่องอบแห้งด้วยแก๊ส รีเอเจนต์ในการนำดีบุกและสังกะสีกลับมาใช้ใหม่จากวัสดุรีไซเคิล เมื่อแปรรูปแร่อลูมิเนียม (บอกไซต์)
โพแทสเซียม– องค์ประกอบของคาบที่ 4 และกลุ่ม IA ของตารางธาตุ หมายเลขซีเรียล 19 สูตรอิเล็กทรอนิกส์ของอะตอม [ 18 Ar]4s 1 สถานะออกซิเดชัน +I และ 0 มีอิเล็กโตรเนกาติวีตี้ต่ำ (0.91) จัดแสดงโลหะ (พื้นฐาน) คุณสมบัติ. ก่อตัว (เป็นไอออนบวก) เกลือและสารประกอบไบนารีจำนวนมาก เกลือโพแทสเซียมเกือบทั้งหมดละลายได้ดีในน้ำ
ในธรรมชาติ - เก้าจากความอุดมสมบูรณ์ทางเคมี ธาตุ (อันดับที่ 6 ในบรรดาโลหะ) จะพบได้เฉพาะในรูปของสารประกอบเท่านั้น เป็นองค์ประกอบสำคัญสำหรับสิ่งมีชีวิตทุกชนิด
การขาดโพแทสเซียมในดินได้รับการชดเชยด้วยการใช้ปุ๋ยโพแทสเซียม - KCl คลอไรด์, ซัลเฟต K2SO4 และเถ้าพืช
โพแทสเซียม โพแทสเซียมไอออน และสารประกอบของโพแทสเซียมทำให้เปลวไฟของเตาแก๊สเป็นสีม่วง ( การตรวจสอบเชิงคุณภาพ)
โพแทสเซียมถึง.โลหะสีเงิน-ขาว เบา อ่อนมาก จุดหลอมเหลวต่ำ เก็บโพแทสเซียมไว้ใต้ชั้นน้ำมันก๊าด ด้วยปรอทจะเกิดเป็นโลหะผสมเหลว - มัลกัม
โดย คุณสมบัติทางเคมีคล้ายกับโซเดียม แต่มีปฏิกิริยามากกว่า ในอากาศชื้น มันจะจางหายไป และถูกปกคลุมไปด้วยฟิล์มไฮดรอกไซด์
โพแทสเซียมแสดงคุณสมบัติการรีดิวซ์ที่รุนแรง มันเผาไหม้ในอากาศอย่างแข็งขันถึง KO 2 ทำปฏิกิริยากับไฮโดรเจน (ผลิตภัณฑ์ KH) คลอรีน (KCl) ซัลเฟอร์ (K 2 S)
มีพลังและสูง ภายนอก- ผลของโพแทสเซียมสลายน้ำ:
2K + 2H 2 O = 2KOH + H 2 ^ + 392 กิโลจูล
ไฮโดรเจนที่ปล่อยออกมาจะติดไฟทันที
ในชุดแรงดันไฟฟ้าโพแทสเซียมจะอยู่ทางด้านซ้ายของไฮโดรเจนอย่างมีนัยสำคัญ จากกรดเจือจาง HCl และ H 2 SO 4 จะแทนที่ไฮโดรเจน (เนื่องจาก H 2 O และ H +) ในขณะที่กรดซัลฟิวริกจะลดลงบางส่วนเป็น SO 2
ใบเสร็จโพแทสเซียมใน อุตสาหกรรมเช่นเดียวกับการได้รับโซเดียม
โพแทสเซียมใช้สำหรับการสังเคราะห์สารประกอบ (KO 2, KH, เกลือ) ในรูปของการหลอม (ผสมกับ Na) - เป็นสารหล่อเย็นในเครื่องปฏิกรณ์นิวเคลียร์
โพแทสเซียมไฮดรอกไซด์คอนไฮดรอกไซด์พื้นฐาน ด่าง ชื่อทางเทคนิค โปแตชกัดกร่อนสีขาว มีโครงสร้างไอออนิก K + OH - . ละลายและเดือดโดยไม่สลายตัว มันแพร่กระจายในอากาศและดูดซับคาร์บอนไดออกไซด์ (เกิด KHCO 3) ทำให้เกิดแผลไหม้อย่างรุนแรงต่อผิวหนังและดวงตา.
ละลายน้ำได้สูง (มีสูง ภายนอก-เอฟเฟกต์) สร้างสภาพแวดล้อมที่มีความเป็นด่างสูงในสารละลาย ทำให้เป็นกลางด้วยกรด ทำปฏิกิริยากับกรดออกไซด์ แอมโฟเทอริกไฮดรอกไซด์ และออกไซด์ สารละลายเข้มข้นกัดกร่อนแก้ว (เกิด K 2 SiO 3)
ปฏิกิริยาและวิธีการที่สำคัญที่สุดในการผลิต KOH ในอุตสาหกรรมนั้นคล้ายคลึงกับคุณสมบัติและการผลิต NaOH
KOH ใช้ในการผลิตสบู่เป็นตัวดูดซับก๊าซ สารทำให้ขาดน้ำ และสารตกตะกอนสำหรับไฮดรอกไซด์ของโลหะที่ไม่ละลายน้ำ
5.3. แคลเซียม
แคลเซียม– องค์ประกอบของคาบที่ 4 และหมู่ IIA ของตารางธาตุ เลขลำดับ 2O สูตรอิเล็กทรอนิกส์ของอะตอม [ 18 Ar]4s 2 , สถานะออกซิเดชัน +II และ 0 หมายถึงโลหะอัลคาไลน์เอิร์ธ
มีอิเลคโตรเนกาติวีตี้ต่ำ (1.04) และแสดงคุณสมบัติของโลหะ (พื้นฐาน) ก่อตัวเป็นเกลือและสารประกอบไบนารีจำนวนมาก (เป็นไอออนบวก) เกลือแคลเซียมหลายชนิดละลายได้ในน้ำเล็กน้อย
ในธรรมชาติ - ที่หกในแง่ของความอุดมสมบูรณ์ทางเคมี ธาตุ (อันดับที่ 3 ในบรรดาโลหะ) จะอยู่ในรูปแบบที่ถูกผูกไว้ เป็นองค์ประกอบสำคัญสำหรับสิ่งมีชีวิตทุกชนิด
การขาดแคลเซียมในดินจะชดเชยด้วยการเติม ปุ๋ยมะนาว(CaCO 3, CaO, แคลเซียมไซยานาไมด์ CaCN 2 ฯลฯ)
แคลเซียม แคลเซียมไอออนบวก และสารประกอบของแคลเซียมจะทำให้เปลวไฟของเตาแก๊สเป็นสีส้มเข้ม ( การตรวจสอบเชิงคุณภาพ)
แคลเซียมส.โลหะสีเงินสีขาว อ่อนนุ่ม เหนียว ในอากาศชื้น สารจะจางหายไปและปกคลุมไปด้วยฟิล์ม CaO และ Ca(OH) 2
มีปฏิกิริยามาก ติดไฟเมื่อได้รับความร้อนในอากาศ ทำปฏิกิริยากับไฮโดรเจน คลอรีน ซัลเฟอร์ และกราไฟท์:

ลดโลหะอื่นๆ จากออกไซด์ (วิธีการที่สำคัญทางอุตสาหกรรม - แคลเซียมเธอร์เจียม):
ZCa + Cr 2 O 3 = ZCaO + 2Cr (700–800 °C)
5Ca + V 2 O 5 = 5CaO + 2V (950 °C)
ทำปฏิกิริยาอย่างแรงกับน้ำ (มีค่าสูง ภายนอก-ผล):
Ca + 2H 2 O = Ca(OH) 2 + H 2 ^ + 413 กิโลจูล
ในซีรีย์แรงดันไฟฟ้าจะอยู่ทางด้านซ้ายของไฮโดรเจนอย่างมีนัยสำคัญ โดยจะแทนที่ไฮโดรเจนจากกรดเจือจาง HCl และ H 2 SO 4 (เนื่องจาก H 2 O และ H +):
Ca + 2H+ = Ca 2+ + H 2 ^
ใบเสร็จแคลเซียมเข้า อุตสาหกรรม:
แคลเซียมใช้ในการกำจัดสิ่งเจือปนที่ไม่ใช่โลหะออกจากโลหะผสม ซึ่งเป็นส่วนประกอบของโลหะผสมที่เบาและต้านการเสียดสี และเพื่อแยกโลหะหายากออกจากออกไซด์
แคลเซียมออกไซด์เซา.ออกไซด์พื้นฐาน ชื่อทางเทคนิค ปูนขาว.ขาวดูดความชื้นมาก มีโครงสร้างไอออนิก Ca 2+ O 2- . ทนไฟ มีความเสถียรต่อความร้อน ระเหยง่ายเมื่อติดไฟ ดูดซับความชื้นและคาร์บอนไดออกไซด์จากอากาศ ทำปฏิกิริยาอย่างแรงกับน้ำ (มีค่าสูง ภายนอก- เอฟเฟกต์) ก่อให้เกิดสารละลายที่มีความเป็นด่างสูง (สามารถตกตะกอนไฮดรอกไซด์ได้) กระบวนการนี้เรียกว่า มะนาวทำปฏิกิริยากับกรด โลหะ และอโลหะออกไซด์ ใช้สำหรับการสังเคราะห์สารประกอบแคลเซียมอื่นๆ ในการผลิต Ca(OH) 2, CaC 2 และปุ๋ยแร่ธาตุ เป็นฟลักซ์ในโลหะวิทยา ตัวเร่งปฏิกิริยาในการสังเคราะห์สารอินทรีย์ และเป็นส่วนประกอบของวัสดุยึดเกาะในการก่อสร้าง
สมการของปฏิกิริยาที่สำคัญที่สุด:

ใบเสร็จ CaO เข้า อุตสาหกรรม– การเผาหินปูน (900-1200 °C):
แคลเซียมคาร์บอเนต 3 = เซา+ คาร์บอนไดออกไซด์ 2
แคลเซียมไฮดรอกไซด์แคลเซียม(OH) 2.ไฮดรอกไซด์พื้นฐาน ชื่อทางเทคนิค มะนาวสุกสีขาวดูดความชื้น. มีโครงสร้างไอออนิก Ca 2+ (OH -) 2 สลายตัวเมื่อได้รับความร้อนปานกลาง ดูดซับความชื้นและคาร์บอนไดออกไซด์จากอากาศ ละลายได้เล็กน้อยในน้ำเย็น (เกิดสารละลายอัลคาไลน์) และละลายได้น้อยกว่าในน้ำเดือด สารละลายโปร่งใส ( น้ำมะนาว)กลายเป็นเมฆมากอย่างรวดเร็วเนื่องจากการตกตะกอนของตะกอนไฮดรอกไซด์ (เรียกว่าสารแขวนลอย นมมะนาว) ปฏิกิริยาเชิงคุณภาพสำหรับไอออน Ca 2+ - ส่งก๊าซคาร์บอนไดออกไซด์ผ่านน้ำมะนาวโดยมีลักษณะเป็นตะกอน CaCO 3 และเปลี่ยนเป็นสารละลาย ทำปฏิกิริยากับกรดและกรดออกไซด์ เข้าสู่ปฏิกิริยาแลกเปลี่ยนไอออน
ใช้ในการผลิตแก้ว ฟอกขาว ปุ๋ยแร่มะนาว สำหรับโซดาไฟและทำให้นิ่ม น้ำจืดเช่นเดียวกับการเตรียมปูนขาว - ส่วนผสมคล้ายแป้ง (ทราย + ปูนขาว + น้ำ) ทำหน้าที่เป็นวัสดุยึดเกาะสำหรับหินและงานก่ออิฐการตกแต่งผนัง (ฉาบปูน) และวัตถุประสงค์ในการก่อสร้างอื่น ๆ การแข็งตัว (“การตั้งค่า”) ของสารละลายดังกล่าวเกิดจากการดูดซับคาร์บอนไดออกไซด์จากอากาศ
สมการของปฏิกิริยาที่สำคัญที่สุด:

ใบเสร็จ Ca(OH) 2 นิ้ว อุตสาหกรรม– ปูนขาว CaO (ดูด้านบน)
5.4. ความกระด้างของน้ำ
น้ำธรรมชาติที่ไหลผ่านหินและดินที่เป็นปูน อุดมไปด้วยเกลือแคลเซียมและแมกนีเซียม (รวมถึงธาตุเหล็ก) และกลายเป็น ยาก.เมื่อซักเสื้อผ้าในน้ำกระด้าง ปริมาณการใช้สบู่จะเพิ่มขึ้น และผ้าที่ดูดซับเกลือจะกลายเป็นสีเหลืองและเสื่อมสภาพอย่างรวดเร็ว มาตราส่วน -สารประกอบที่ไม่ละลายน้ำของแคลเซียม แมกนีเซียม และเหล็กออกไซด์) สะสมอยู่บนผนังด้านในของจาน หม้อต้มไอน้ำ และท่อ ผัก ธัญพืช และเนื้อสัตว์ใช้เวลาปรุงในน้ำกระด้างนานกว่า แยกแยะ ชั่วคราวและ คงที่ความกระด้างของน้ำ
ความกระด้างชั่วคราวเกิดจากการมีไฮโดรคาร์บอเนต M(HCO 3) 2 (M = Ca, Mg) และ Fe(HCO 3) 2 อยู่ในน้ำ หากมีปริมาณเนื้อหาของ HCO 3 - ไอออนก็จะพูดถึง คาร์บอเนตความแข็งหากเนื้อหาของไอออน Ca 2+, Mg 2+ และ Fe 2+ เป็นเรื่องเกี่ยวกับ แคลเซียมแมกนีเซียมหรือ เหล็กความแข็งแกร่ง ความกระด้างชั่วคราวจะสูงขึ้น ปริมาณของไอออนเหล่านี้ในน้ำก็จะยิ่งสูงขึ้น ความกระด้างของน้ำเรียกว่าชั่วคราวเพราะสามารถกำจัดได้โดยการต้มง่ายๆ:
Ca(HCO 3) 2 = CaCO 3 v + H 2 O + CO 2 ^
มก.(HCO 3) 2 = มก.(OH) 2 v + 2СO 2 ^
4เฟ(HCO 3) 2 + O 2 = 2Fe 2 O 3 โวลต์ + 8CO 2 ^ + 4H 2 O
คงที่ความกระด้างเกิดจากเกลือแคลเซียมและแมกนีเซียมอื่นๆ (ซัลเฟต, คลอไรด์, ไนเตรต, ไดไฮโดรเจนออร์โธฟอสเฟต ฯลฯ ) ความกระด้างนี้ไม่สามารถกำจัดได้ด้วยน้ำเดือด ดังนั้น ในการกำจัดเกลือส่วนใหญ่ออกจากน้ำกระด้าง จะต้องทำให้อ่อนตัวลงโดยใช้รีเอเจนต์เคมีและวิธีการพิเศษ (การแลกเปลี่ยนไอออน) น้ำอ่อนเหมาะสำหรับดื่มและปรุงอาหาร
การทำให้น้ำอ่อนตัวทำได้สำเร็จหากได้รับการบำบัดด้วยสารตกตะกอนต่างๆ - ปูนขาวโซดาและโซเดียมออร์โธฟอสเฟต:
การกำจัดความแข็งแกร่งชั่วคราว:
Ca(HCO 3) 2 + Ca(OH) 2 = 2CaCO 3 v + 2H 2 O
Mg(HCO 3) 2 + Ca(OH) 2 = CaMg(CO 3) 2 v + 2H 2 O
4Fe(HCO3) 2 + 8Ca(OH) 2 + O 2 = 4FeO(OH)v + 8CaCO 3 โวลต์ + 10H 2 O
ขจัดความแข็งถาวร:
แคลเซียม(NO 3) 2 + นา 2 CO 3 = CaCO 3 v + 2NaNO 3
2MgSO 4 + H 2 O = นา 2 CO 3 = Mg 2 CO 3 (OH) 2 v + CO 2 ^ + 2Na 2 SO 4
3FeCl 2 + 2Na 3 PO 4 = เฟ 3 (PO 4) 2 โวลต์ + 6NaCl
ในห้องปฏิบัติการเคมีและในอุตสาหกรรม มีการใช้น้ำปราศจากแร่ธาตุอย่างสมบูรณ์ (ไม่เหมาะสำหรับการดื่ม) เพื่อให้ได้น้ำที่แยกเกลือออก น้ำธรรมชาติจะต้องผ่านการกลั่น เช่น กลั่นน้ำก็นุ่มเหมือนน้ำฝน
5.5. อลูมิเนียม
อลูมิเนียม– องค์ประกอบของคาบที่ 3 และกลุ่ม IIIA ของตารางธาตุ หมายเลขซีเรียล 13 สูตรอิเล็กทรอนิกส์ของอะตอม [ 10 Ne]3s 2 3p 1 สถานะออกซิเดชัน + III และ 0
อิเล็กโทรเนกาติวีตี้ (1.47) เหมือนกับเบริลเลียมและมีคุณสมบัติเป็นแอมโฟเทอริก (เป็นกรดและเป็นเบส) ในสารประกอบอาจมีอยู่ในแคตไอออนและแอนไอออน
ในธรรมชาติ - ที่สี่ในแง่ของความอุดมสมบูรณ์ทางเคมี ธาตุ (อันดับแรกในบรรดาโลหะ) อยู่ในสถานะผูกพันทางเคมี
อลูมิเนียมอัล- โลหะสีขาวเงิน มันเงา น้ำหนักเบาและเหนียว ในอากาศถูกปกคลุมด้วยฟิล์มป้องกันด้าน Al 2 O 3 ซึ่งมีความเสถียรมากและปกป้องโลหะจากการกัดกร่อน ซึมผ่านในน้ำและทำให้ HNO 3 เข้มข้น (เกิดเป็นฟิล์มออกไซด์เดียวกัน)
เกิดปฏิกิริยา ไหม้ในอากาศ เมื่อใด อุณหภูมิห้องทำปฏิกิริยากับฮาโลเจน Cl 2, Br 2 และ I 2 และเมื่อถูกความร้อน - กับฟลูออรีน, ซัลเฟอร์:
4Al (ผง) + 3O 2 (อากาศ) = 2Al 2 O 3 (700 °C)
2Al (ผง) + ZE 2 = 2AlE 3 (25 °C, E = CI, Br)
2Al (ผง) + 3I 2 = 2AlI 3 (25 °C, cat. - หยด H 2 O)
2อัล + 3F 2 = 2อัลเอฟ 3 (600 °C)
2อัล + 3S = อัล 2 ส 3 (150–200 °C)
อลูมิเนียมจะลดโลหะอื่นๆ จากออกไซด์ (วิธีการที่สำคัญทางอุตสาหกรรม - อะลูมิเนียมอุณหภูมิ):

อะลูมิเนียมผสม เช่น เคลียร์ฟิล์มออกไซด์อย่างแรงและดีเยี่ยม ภายนอก-ทำปฏิกิริยากับน้ำ:
2Al + 6H 2 O = 2Al(OH) 3 v + ZH 2 ^ + 836 กิโลจูล
อลูมิเนียมเป็นตัวรีดิวซ์ที่แรง (ทั่วไป) โดยในชุดแรงดันไฟฟ้าจะอยู่ทางด้านซ้ายของไฮโดรเจนอย่างมาก แทนที่ไฮโดรเจนจากกรดเจือจาง HCl และ H2SO4:
2Al + 6Н+ = 2Al 3+ + ЗН 2 ^
และแสดงแอมโฟเทอริซิตี้จากสารละลายเข้มข้นของอัลคาลิส (ตัวออกซิไดซ์ - น้ำ):
2Al + 2NaOH + 6Н 2 O = 2Na + ЗН 2 ^ (80 °C)
ทำปฏิกิริยากับด่างในการหลอมเหลว (ยังแสดงให้เห็นคุณสมบัติแอมโฟเทอริกด้วย):
2Al + 6NaOH (T) = 2NaAlO 2 + ZN 2 + 2Na 2 O (450 °C)
มีปฏิสัมพันธ์กับ เจือจางกรดไนตริก:
อัล + 4HNO 3 (เจือจาง) = อัล(NO 3) 3 + NO^ + 2H 2 O
และลด Nv เป็น N-III เมื่อทำปฏิกิริยากับ เจือจางมากกรดไนตริกและเกลือของมัน:
8Al + 30НNO 3 (เจือจางมาก) = 8Al(NO 3) 3 + 3NH 4 NO 3 + 9Н 2 O
8Al + 18H 2 O + 5KOH + 3KNO 3 = 8K + 3NH 3 ^ (เดือด)
(แรงผลักดันของปฏิกิริยาเหล่านี้คือการปลดปล่อยอะตอมไฮโดรเจน H0 ระดับกลางและในปฏิกิริยาที่สองก็เกิดการก่อตัวของไฮดรอกโซคอมเพล็กซ์ที่เสถียร -)
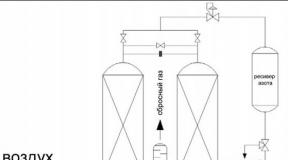
ใบเสร็จอลูมิเนียมเข้า อุตสาหกรรม– อิเล็กโทรไลซิสของ Al 2 O 3 ในไครโอไลท์ Na 3 ละลายที่ 950 °C:
ใช้เป็นรีเอเจนต์ในอะลูมิเนียมอุณหภูมิเพื่อการผลิตโลหะหายากและการเชื่อมด้วยเทอร์ไมต์ โครงสร้างเหล็ก- อลูมิเนียมเป็นวัสดุโครงสร้างที่สำคัญที่สุด ซึ่งเป็นพื้นฐานของโลหะผสมที่ทนต่อการกัดกร่อนเล็กน้อย (ที่มีแมกนีเซียม - ดูราลูมิน,หรือ ดูราลูมิน,ด้วยทองแดง - สีเหลืองอลูมิเนียมสีบรอนซ์,ซึ่งเหรียญเปลี่ยนเล็กน้อยจะถูกสร้างเสร็จ) อลูมิเนียมบริสุทธิ์ถูกนำมาใช้ในปริมาณมากเพื่อทำอาหารและสายไฟ
อลูมิเนียมออกไซด์อัล 2 โอ 3 .คุณสมบัติแอมโฟเทอริกออกไซด์ความเป็นกรดและพื้นฐานมีความเด่นชัดเท่าเทียมกัน สีขาว มีโครงสร้างไอออนิก (Al 3+) 2 (O 2-) 3. ทนไฟ มีความเสถียรทางความร้อน ผงอสัณฐานดูดความชื้นและมีฤทธิ์ทางเคมี ผงผลึกมีความแข็งมากและเป็นแบบพาสซีฟทางเคมี ไม่ทำปฏิกิริยากับน้ำ กรดเจือจาง และด่าง มันถูกถ่ายโอนไปยังสารละลายด้วยกรดและด่างเข้มข้น และทำปฏิกิริยากับด่างและโซเดียมคาร์บอเนตในระหว่างการหลอมรวม ใช้เป็นวัตถุดิบในการผลิตอลูมิเนียมสำหรับการผลิตวัสดุทนไฟ ทนต่อสารเคมี และมีฤทธิ์กัดกร่อน โดยเฉพาะอัล 2 โอ 3 บริสุทธิ์ - สำหรับการผลิตเลเซอร์ทับทิมและอัญมณีสังเคราะห์ (ทับทิม แซฟไฟร์ ฯลฯ .) แต่งสีด้วยออกไซด์ของโลหะอื่นเจือปน - Cr 2 O 3 (สีแดง), Ti 2 O 3 และ Fe 2 O 3 (สีน้ำเงิน)
สมการของปฏิกิริยาที่สำคัญที่สุด:

(ปฏิกิริยานี้ใช้เพื่อ "เปิด" บอกไซต์)
ในธรรมชาติก็เป็นส่วนหนึ่งของ ดินเหนียวและ แร่อะลูมิเนียม,ก่อให้เกิดแร่ธาตุ คอรันดัม.
อะลูมิเนียมไฮดรอกไซด์อัล(OH) 3 .คุณสมบัติแอมโฟเทอริกไฮดรอกไซด์ความเป็นกรดและพื้นฐานมีความเด่นชัดเท่าเทียมกัน สีขาว อสัณฐาน (คล้ายเจล) หรือผลึก พันธะ Al–OH ส่วนใหญ่เป็นโควาเลนต์ สลายตัวเมื่อได้รับความร้อนโดยไม่ละลาย แทบไม่ละลายในน้ำ ทำปฏิกิริยากับกรด ด่างในสารละลายและระหว่างการหลอมรวม ไม่ทำปฏิกิริยากับ NH 3 H 2 O, NH 4 Cl, CO 2, SO 2 และ H 2 S. เมตาไฮดรอกไซด์ AlO(OH) มีฤทธิ์ทางเคมีน้อยกว่า Al(OH) 3 ผลิตภัณฑ์ขั้นกลางในการผลิตอะลูมิเนียม ใช้สำหรับการสังเคราะห์สารประกอบอะลูมิเนียมอื่นๆ (ได้แก่ ไครโอไลท์)สีย้อมอินทรีย์เช่น ผลิตภัณฑ์ยาด้วยความเป็นกรดที่เพิ่มขึ้นของน้ำย่อย
สมการของปฏิกิริยาที่สำคัญที่สุด:
การสลายตัวด้วยความร้อน
การแยกตัวขั้นพื้นฐานและกรดในสารละลาย
(ปฏิกิริยามีลักษณะเป็นความสามารถในการละลายน้ำต่ำมากและธรรมชาติของไฮดรอกไซด์แอมโฟเทอริกซึ่งจ่ายไอออน OH และ H + ให้กับสารละลายพร้อมกันในความเข้มข้นที่เท่ากันโดยประมาณ ไฮดรอกไซด์แยกตัวออกอย่างแรงน้อยกว่าน้ำเอง)
คุณสมบัติของแอมโฟเทอริก
อัล(OH) 3 + ZHldil.) = AlCl 3 + ZH 2 O
อัล(OH) 3 + NaOH (t) = NaAlO 2 + 2H 2 O (1,000 °C)
อัล(OH) 3 + NaOH(เข้มข้น) = นา (p)
สำหรับ การรับตะกอน Al(OH) 3 โดยปกติจะไม่ใช้อัลคาไลเนื่องจากเปลี่ยนตะกอนเป็นสารละลายได้ง่าย (ดูด้านบน) แต่จะออกฤทธิ์กับเกลืออะลูมิเนียมที่มีแอมโมเนียไฮเดรต ที่อุณหภูมิห้อง จะเกิด Al(OH) 3 และเมื่อเดือด AlO(OH) จะทำงานน้อยลง:
วิธีที่สะดวกในการรับ Al(OH) 3 คือการส่ง CO 2 ผ่านสารละลายของไฮดรอกโซคอมเพล็กซ์:
คาร์บอนไดออกไซด์ 2 = อัล(OH) 3 โวลต์ +เอชซีโอ 3 -
โซเดียมเตตระไฮดรอกซีอะลูมิเนต (III)นาเกลือเชิงซ้อน ด้วยองค์ประกอบนี้ จึงมีอยู่ที่อุณหภูมิห้องในสารละลาย NaOH เข้มข้น สำหรับ สถานะของแข็งองค์ประกอบเป็นไปตามเงื่อนไขเนื่องจากในระหว่างการตกผลึกจากสารละลายจะซับซ้อนมากขึ้น (แยก Na 4, Na 4 ฯลฯ ) เมื่อเผา เกลือแข็งจะสลายตัวเป็นโซเดียมไดออกโซอะลูมิเนต (III) NaAlO 2 และเมื่อสารละลายของพวกมันถูกเจือจาง ก็จะเป็น Al(OH) 3 พวกมันทำปฏิกิริยาต่างกันกับกรดแก่และกรดอ่อน กับอะลูมิเนียมคลอไรด์และแอมโมเนียมคาร์บอเนต
สมการของปฏิกิริยาที่สำคัญที่สุด:

ใบเสร็จ: อันตรกิริยาของ Al(OH) 3 และเกลืออะลูมิเนียมกับ NaOH ในสารละลายเข้มข้น:
อัล(OH) 3 + NaOH(เข้มข้น) = นา
AlCl 3 + 4NaOH(เข้มข้น) = นา+3โซเดียมคลอไรด์
มันถูกสร้างขึ้นจากอลูมิเนียมออกไซด์ (ดู) เป็นผลิตภัณฑ์ขั้นกลางระหว่าง "การเปิด" ทางอุตสาหกรรมของอะลูมิเนียม
ตัวอย่างงาน Part A1. ในบรรดาโลหะของกลุ่มย่อยหลักของกลุ่ม II แข็งแกร่งที่สุดตัวรีดิวซ์คือ
2) แคลเซียม
3) ธาตุโลหะชนิดหนึ่ง
2. เมื่อแมกนีเซียมถูกเผาในอากาศ จะก่อตัวขึ้น
3. อะลูมิเนียมจะปล่อยไฮโดรเจนออกจากรีเอเจนต์
1) HNO 3 (ดิล.)
2) NaHSO 4 (ดิล.)
3) เอช 2 เอส 4 (สรุป)
4) NaOH (เข้มข้น)
4. ปฏิกิริยาการทดแทนเกิดขึ้นในสารละลายระหว่างอลูมิเนียมกับ
5. ตะกอนจะเกิดขึ้นจากสารละลายแบเรียมไบคาร์บอเนตเมื่อเติมรีเอเจนต์
6. สามารถรับโพแทสเซียมได้โดยอิเล็กโทรไลซิสบนอิเล็กโทรดคาร์บอนจาก
1) โซลูชัน KCl
2) โซลูชัน KNO 3
3) ละลาย KCl
4) ละลายส่วนผสมของ KCl และ MgCl 2
7-8. หากคุณเพิ่มสารละลายสักหยด
7.เกลือแกง
8. โพแทสเซียมคลอไรด์
จะกลายเป็นเปลวไฟไร้สีของเตาแก๊ส
1) สีแดง
3) สีเขียว
4) สีม่วง
9. การกำจัดความกระด้างของน้ำชั่วคราวจะดำเนินการตามปฏิกิริยา
1) Ca(HCO 3) 2 + นา 3 PO 4 >...
2) Ca(HCO 3) 2 + Ca(OH) 2 >...
3) CaSO 4 + นา 2 CO 3 >...
แคลเซียม– องค์ประกอบของคาบที่ 4 และหมู่ IIA ของตารางธาตุ เลขลำดับ 2O สูตรอิเล็กทรอนิกส์ของอะตอม [ 18 Ar]4s 2 , สถานะออกซิเดชัน +II และ 0 หมายถึงโลหะอัลคาไลน์เอิร์ธ
มีอิเลคโตรเนกาติวีตี้ต่ำ (1.04) และแสดงคุณสมบัติของโลหะ (พื้นฐาน) ก่อตัวเป็นเกลือและสารประกอบไบนารีจำนวนมาก (เป็นไอออนบวก) เกลือแคลเซียมหลายชนิดละลายได้ในน้ำเล็กน้อย
ในธรรมชาติ - ที่หกในแง่ของความอุดมสมบูรณ์ทางเคมี ธาตุ (อันดับที่ 3 ในบรรดาโลหะ) จะอยู่ในรูปแบบที่ถูกผูกไว้ เป็นองค์ประกอบสำคัญสำหรับสิ่งมีชีวิตทุกชนิด
การขาดแคลเซียมในดินจะชดเชยด้วยการเติม ปุ๋ยมะนาว(CaCO 3, CaO, แคลเซียมไซยานาไมด์ CaCN 2 ฯลฯ)
แคลเซียม แคลเซียมไอออนบวก และสารประกอบของแคลเซียมจะทำให้เปลวไฟของเตาแก๊สเป็นสีส้มเข้ม ( การตรวจสอบเชิงคุณภาพ)
แคลเซียม Ca.โลหะสีเงินสีขาว อ่อนนุ่ม เหนียว ในอากาศชื้น สารจะจางหายไปและปกคลุมไปด้วยฟิล์ม CaO และ Ca(OH) 2
มีปฏิกิริยามาก ติดไฟเมื่อได้รับความร้อนในอากาศ ทำปฏิกิริยากับไฮโดรเจน คลอรีน ซัลเฟอร์ และกราไฟท์:
ลดโลหะอื่นๆ จากออกไซด์ (วิธีการที่สำคัญทางอุตสาหกรรม - แคลเซียมเธอร์เจียม):
ZCa + Cr 2 O 3 = ZCaO + 2Cr (700–800 °C)
5Ca + V 2 O 5 = 5CaO + 2V (950 °C)
ทำปฏิกิริยาอย่างแรงกับน้ำ (มีค่าสูง ภายนอก-ผล):
Ca + 2H 2 O = Ca(OH) 2 + H 2 + 413 กิโลจูล
ในซีรีย์แรงดันไฟฟ้าจะอยู่ทางด้านซ้ายของไฮโดรเจนอย่างมีนัยสำคัญ โดยจะแทนที่ไฮโดรเจนจากกรดเจือจาง HCl และ H 2 SO 4 (เนื่องจาก H 2 O และ H +):
Ca + 2H+ = Ca 2+ + H 2
ใบเสร็จแคลเซียมเข้า อุตสาหกรรม :
แคลเซียมใช้ในการกำจัดสิ่งเจือปนที่ไม่ใช่โลหะออกจากโลหะผสม ซึ่งเป็นส่วนประกอบของโลหะผสมที่เบาและต้านการเสียดสี และเพื่อแยกโลหะหายากออกจากออกไซด์
แคลเซียมออกไซด์ CaOออกไซด์พื้นฐาน ชื่อทางเทคนิค ปูนขาว.ขาวดูดความชื้นมาก มีโครงสร้างไอออนิก: Ca 2+ O 2- ทนไฟ มีความเสถียรต่อความร้อน ระเหยง่ายเมื่อติดไฟ ดูดซับความชื้นและคาร์บอนไดออกไซด์จากอากาศ ทำปฏิกิริยาอย่างแรงกับน้ำ (มีค่าสูง ภายนอก‐เอฟเฟกต์) ทำให้เกิดสารละลายที่มีความเป็นด่างสูง (สามารถตกตะกอนไฮดรอกไซด์ได้) เรียกว่ากระบวนการ มะนาวทำปฏิกิริยากับกรด โลหะ และอโลหะออกไซด์ ใช้สำหรับการสังเคราะห์สารประกอบแคลเซียมอื่นๆ ในการผลิต Ca(OH) 2, CaC 2 และปุ๋ยแร่ธาตุ เป็นฟลักซ์ในโลหะวิทยา ตัวเร่งปฏิกิริยาในการสังเคราะห์สารอินทรีย์ และเป็นส่วนประกอบของวัสดุยึดเกาะในการก่อสร้าง
สมการของปฏิกิริยาที่สำคัญที่สุด:

ใบเสร็จ CaO เข้า อุตสาหกรรม– การเผาหินปูน (900–1200 °C):
แคลเซียมคาร์บอเนต 3 = เซา+ คาร์บอนไดออกไซด์ 2
แคลเซียมไฮดรอกไซด์ Ca(OH) 2ไฮดรอกไซด์พื้นฐาน ชื่อทางเทคนิค มะนาวสุกสีขาวดูดความชื้น. มีโครงสร้างไอออนิก: Ca 2+ (OH -) 2 สลายตัวเมื่อได้รับความร้อนปานกลาง ดูดซับความชื้นและคาร์บอนไดออกไซด์จากอากาศ ละลายได้เล็กน้อยในน้ำเย็น (เกิดสารละลายอัลคาไลน์) และละลายได้น้อยกว่าในน้ำเดือด สารละลายโปร่งใส ( น้ำมะนาว)กลายเป็นเมฆมากอย่างรวดเร็วเนื่องจากการตกตะกอนของไฮดรอกไซด์ตกตะกอน (เรียกว่าสารแขวนลอย นมมะนาว) ปฏิกิริยาเชิงคุณภาพสำหรับไอออน Ca 2+ - ส่งก๊าซคาร์บอนไดออกไซด์ผ่านน้ำมะนาวโดยมีลักษณะเป็นตะกอน CaCO 3 และเปลี่ยนเป็นสารละลาย ทำปฏิกิริยากับกรดและกรดออกไซด์ เข้าสู่ปฏิกิริยาแลกเปลี่ยนไอออน
มันถูกใช้ในการผลิตแก้ว, ปูนขาว, ปุ๋ยแร่มะนาว, สำหรับโซดาไฟและทำให้น้ำจืดอ่อนตัวลง, เช่นเดียวกับการเตรียมปูนขาว - ส่วนผสมคล้ายแป้ง (ทราย + ปูนขาว + น้ำ), ทำหน้าที่เป็นวัสดุยึดเกาะ สำหรับงานหินและอิฐ งานตกแต่ง (ฉาบปูน) ผนัง และวัตถุประสงค์ในการก่อสร้างอื่นๆ การแข็งตัว (“การตั้งค่า”) ของสารละลายดังกล่าวเกิดจากการดูดซับคาร์บอนไดออกไซด์จากอากาศ
สมการของปฏิกิริยาที่สำคัญที่สุด:

ใบเสร็จ Ca(OH) 2 นิ้ว อุตสาหกรรม– ปูนขาว CaO (ดูด้านบน)
5.4. ความกระด้างของน้ำ
น้ำธรรมชาติที่ไหลผ่านหินและดินที่เป็นปูน อุดมไปด้วยเกลือแคลเซียมและแมกนีเซียม (รวมถึงธาตุเหล็ก) และกลายเป็น ยาก.เมื่อซักเสื้อผ้าในน้ำกระด้าง ปริมาณการใช้สบู่จะเพิ่มขึ้น และผ้าที่ดูดซับเกลือจะกลายเป็นสีเหลืองและเสื่อมสภาพอย่างรวดเร็ว มาตราส่วน -สารประกอบที่ไม่ละลายน้ำของแคลเซียม แมกนีเซียม และเหล็กออกไซด์) สะสมอยู่บนผนังด้านในของจาน หม้อต้มไอน้ำ และท่อ ผัก ธัญพืช และเนื้อสัตว์ใช้เวลาปรุงในน้ำกระด้างนานกว่า แยกแยะ ชั่วคราวและ คงที่ความกระด้างของน้ำ
ความกระด้างชั่วคราวเกิดจากการมีไฮโดรคาร์บอเนต M(HCO 3) 2 (M = Ca, Mg) และ Fe(HCO 3) 2 อยู่ในน้ำ หากมีปริมาณเนื้อหาของ HCO 3 - ไอออนก็จะพูดถึง คาร์บอเนตความแข็งหากเนื้อหาของไอออน Ca 2+, Mg 2+ และ Fe 2+ เป็นเรื่องเกี่ยวกับ แคลเซียมแมกนีเซียมหรือ เหล็กความแข็งแกร่ง ความกระด้างชั่วคราวจะสูงขึ้น ปริมาณของไอออนเหล่านี้ในน้ำก็จะยิ่งสูงขึ้น ความกระด้างของน้ำเรียกว่าชั่วคราวเพราะสามารถกำจัดได้โดยการต้มง่ายๆ:
Ca(HCO 3) 2 = CaCO 3 ↓ + H 2 O + CO 2
มก.(HCO 3) 2 = มก.(OH) 2 ↓ + 2СO 2
4เฟ(HCO 3) 2 + O 2 = 2เฟ 2 โอ 3 ↓ + 8CO 2 + 4H 2 O
คงที่ความกระด้างเกิดจากเกลือแคลเซียมและแมกนีเซียมอื่นๆ (ซัลเฟต, คลอไรด์, ไนเตรต, ไดไฮโดรออร์โธฟอสเฟต ฯลฯ ) ความกระด้างนี้ไม่สามารถกำจัดได้ด้วยน้ำเดือด ดังนั้น ในการกำจัดเกลือส่วนใหญ่ออกจากน้ำกระด้าง จะต้องทำให้อ่อนตัวลงโดยใช้รีเอเจนต์เคมีและวิธีการพิเศษ (การแลกเปลี่ยนไอออน) น้ำอ่อนเหมาะสำหรับดื่มและปรุงอาหาร
การทำให้น้ำอ่อนตัวทำได้สำเร็จหากได้รับการบำบัดด้วยสารตกตะกอนต่างๆ - ปูนขาวโซดาและโซเดียมออร์โธฟอสเฟต:
การกำจัดความแข็งแกร่งชั่วคราว:
Ca(HCO 3) 2 + Ca(OH) 2 = 2CaCO 3 ↓ + 2H 2 O
Mg(HCO 3) 2 + Ca(OH) 2 = CaMg(CO 3) 2 ↓ + 2H 2 O
4Fe(HCO 3) 2 + 8Ca(OH) 2 + O 2 = 4FeO(OH)↓ + 8CaCO 3 ↓ + 10H 2 O
ขจัดความแข็งถาวร:
แคลเซียม(NO 3) 2 + นา 2 CO 3 = CaCO 3 ↓ + 2NaNO 3
2MgSO 4 + H 2 O = นา 2 CO 3 = Mg 2 CO 3 (OH) 2 ↓ + CO 2 + 2Na 2 SO 4
3FeCl 2 + 2Na 3 PO 4 = เฟ 3 (PO 4) 2 ↓ + 6NaCl
ในห้องปฏิบัติการเคมีและในอุตสาหกรรม มีการใช้น้ำปราศจากแร่ธาตุอย่างสมบูรณ์ (ไม่เหมาะสำหรับการดื่ม) เพื่อให้ได้น้ำที่แยกเกลือออก น้ำธรรมชาติจะต้องผ่านการกลั่น เช่น กลั่นน้ำก็นุ่มเหมือนน้ำฝน
โพแทสเซียม
โซเดียม
วัสดุและการสนับสนุนทางเทคนิคของวินัย
อ่านเพิ่มเติม
วรรณกรรมพื้นฐาน
วินัย
การสนับสนุนด้านการศึกษา วิธีการ และข้อมูล
Khakhanina T.I. เคมี สิ่งแวดล้อม[ทรัพยากรอิเล็กทรอนิกส์]: คู่มือการฝึกอบรม- อ.: YURAIT, 2010. – 129 น. //ห้องสมุดมหาวิทยาลัยออนไลน์: เว็บไซต์. - โหมดการเข้าถึง: http://www.biblioclub.ru
1. Tarasova, Natalia Pavlovna เคมีสิ่งแวดล้อม: บรรยากาศ: หนังสือเรียน. ความช่วยเหลือสำหรับนักเรียน มหาวิทยาลัย / N. P. Tarasova, V. A. Kuznetsov - อ.: Academy, 2550. - 227 น. เอซิปอฟ, ยูริ เวเนียมิโนวิช.
การติดตามและการประเมินความเสี่ยงของระบบ "การป้องกัน - วัตถุ - สภาพแวดล้อม" / Yu. V. Esipov, F. A. Samsonov, A. I. Cheremisin; RAS ภาคใต้ ทางวิทยาศาสตร์ ศูนย์. - อ.: URSS, 2551. - 136 น.
2. Larionov N. M. นิเวศวิทยาอุตสาหกรรม [แหล่งข้อมูลอิเล็กทรอนิกส์]: หนังสือเรียนระดับปริญญาตรี - อ.: YURAYT, 2012. – 496 หน้า // ห้องสมุดมหาวิทยาลัยออนไลน์: เว็บไซต์. - โหมดการเข้าถึง: http://www.biblioclub.ru
เพื่อดำเนินการ โปรแกรมการทำงานระเบียบวินัย "เคมีแห่งชีวมณฑล" แผนกนี้มีฐานวัสดุและเทคนิคที่ช่วยให้มั่นใจว่าการฝึกอบรมทุกประเภทการปฏิบัติงานและการวิจัยของนักศึกษาสอดคล้องกับกฎและข้อบังคับด้านสุขอนามัยและความปลอดภัยจากอัคคีภัยในปัจจุบัน ชั้นเรียนแบบโต้ตอบจะจัดขึ้นในห้องเรียนที่มีอุปกรณ์มัลติมีเดียและอินเทอร์เน็ต
โซเดียม– องค์ประกอบของคาบที่ 3 และกลุ่ม IA ของตารางธาตุ เลขลำดับ 11 สูตรอิเล็กทรอนิกส์ของอะตอม [ 10 Ne]3s 1 สถานะออกซิเดชัน +I และ 0 มีอิเล็กโทรเนกาติวีตี้ต่ำ (0.93) จัดแสดงเฉพาะโลหะ (พื้นฐาน) คุณสมบัติ . ก่อตัว (เป็นไอออนบวก) เกลือและสารประกอบไบนารีจำนวนมาก เกลือโซเดียมเกือบทั้งหมดละลายได้ดีในน้ำ
ในธรรมชาติ - ที่ห้าธาตุที่มีความอุดมสมบูรณ์ทางเคมี (รองจากโลหะ) พบเฉพาะในรูปของสารประกอบเท่านั้น เป็นองค์ประกอบสำคัญสำหรับสิ่งมีชีวิตทุกชนิด
โซเดียม โซเดียมไอออนบวก และสารประกอบของมันทำให้เปลวไฟของเตาแก๊สมีสีเหลืองสดใส ( การตรวจสอบเชิงคุณภาพ)
โซเดียมนา โลหะสีเงิน-ขาว บางเบา นุ่มนวล (มีดตัดได้) ละลายต่ำ เก็บโซเดียมไว้ในน้ำมันก๊าด ก่อตัวเป็นโลหะผสมเหลวกับปรอท - มัลกัม(สูงถึง 0.2% นา)
โซเดียมที่มีปฏิกิริยาสูงในอากาศชื้นจะค่อยๆ เคลือบด้วยฟิล์มไฮดรอกไซด์และสูญเสียความมันวาว (ทำให้เสื่อมเสีย):
โซเดียมมีฤทธิ์ทางเคมีและเป็นสารรีดิวซ์ที่รุนแรง ติดไฟในอากาศที่อุณหภูมิความร้อนปานกลาง (>250 °C) ทำปฏิกิริยากับอโลหะ:
2Na + O 2 = นา 2 O 2 2Na + H 2 = 2NaH
2Na + Cl 2 = 2NaCl 2Na + S = นา 2 ส
6Na + N 2 = 2Na 3 N 2Na + 2C = นา 2 C 2
พายุมากและยิ่งใหญ่มาก ภายนอกผลของโซเดียมทำปฏิกิริยากับน้ำ:
2Na + 2H 2 O = 2NaOH + H 2 + 368 กิโลจูล
จากความร้อนของปฏิกิริยา ชิ้นส่วนของโซเดียมจะละลายเป็นลูกบอล ซึ่งเริ่มเคลื่อนที่แบบสุ่มเนื่องจากการปลดปล่อย H 2 ปฏิกิริยาจะมาพร้อมกับการคลิกอย่างรวดเร็วเนื่องจากการระเบิดของก๊าซระเบิด (H 2 + O 2) สารละลายเป็นสีแดงเข้มพร้อมฟีนอล์ฟทาลีน (ตัวกลางที่เป็นด่าง)
ในอนุกรมแรงดันไฟฟ้า โซเดียมจะอยู่ทางด้านซ้ายของไฮโดรเจนอย่างมีนัยสำคัญ โดยจะแทนที่ไฮโดรเจนจากกรดเจือจาง HCl และ H 2 SO 4 (เนื่องจาก H 2 O และ H +)
ใบเสร็จโซเดียมในอุตสาหกรรม:
(ดูการเตรียม NaOH ด้านล่างด้วย)
โซเดียมใช้ในการผลิต Na 2 O 2, NaOH, NaH รวมถึงการสังเคราะห์สารอินทรีย์ โซเดียมหลอมเหลวทำหน้าที่เป็นสารหล่อเย็นในเครื่องปฏิกรณ์นิวเคลียร์ และใช้โซเดียมที่เป็นก๊าซเป็นตัวเติมสำหรับโคมไฟกลางแจ้งที่มีแสงสีเหลือง
โซเดียมออกไซด์ Na 2 O. ออกไซด์พื้นฐาน สีขาว มีโครงสร้างไอออนิก (Na +) 2 O 2‑ มีความเสถียรทางความร้อน สลายตัวช้าๆ เมื่อถูกความร้อน ละลายภายใต้ความดันไอ Na ที่มากเกินไป ไวต่อความชื้นและคาร์บอนไดออกไซด์ในอากาศ ทำปฏิกิริยาอย่างแรงกับน้ำ (เกิดสารละลายที่เป็นด่างแก่), กรด, ออกไซด์ที่เป็นกรดและแอมโฟเทอริก, ออกซิเจน (ภายใต้ความดัน) ใช้สำหรับการสังเคราะห์เกลือโซเดียม ไม่ได้เกิดขึ้นเมื่อโซเดียมถูกเผาในอากาศ
สมการของปฏิกิริยาที่สำคัญที่สุด:
ใบเสร็จ:การสลายตัวทางความร้อนของ Na 2 O 2 (ดู) รวมถึงการหลอมรวมของ Na และ NaOH, Na และ Na 2 O 2:
2Na + 2NaOH = 2Na a O + H 2 (600 °C)
2Na + Na 2 O 2 = 2Na a O (130–200 °C)
โซเดียมเปอร์ออกไซด์ นา 2 โอ 2- การเชื่อมต่อแบบไบนารี สีขาวดูดความชื้น. มีโครงสร้างไอออนิก (Na +) 2 O 2 2- เมื่อถูกความร้อนจะสลายตัวและละลายภายใต้ความดันส่วนเกิน O 2 . ดูดซับคาร์บอนไดออกไซด์จากอากาศ สลายตัวอย่างสมบูรณ์ด้วยน้ำ, กรด (ปล่อย O 2 ออกมาระหว่างการเดือด - ปฏิกิริยาเชิงคุณภาพสำหรับเปอร์ออกไซด์) ตัวออกซิไดซ์ที่แรง, ตัวรีดิวซ์ที่อ่อนแอ ใช้สำหรับการสร้างออกซิเจนใหม่ในอุปกรณ์ช่วยหายใจแบบมีถังอากาศในตัว (ทำปฏิกิริยากับ CO 2) โดยเป็นส่วนประกอบของสารฟอกขาวสำหรับผ้าและกระดาษ สมการของปฏิกิริยาที่สำคัญที่สุด:
2Na 2 O 2 = 2Na 2 O + O 2 (400–675 °C สุญญากาศ)
Na 2 O 2 + 2H 2 O = H 2 O 2 + 2NaOH (ในที่เย็น)
2Na 2 O 2 + 2H 2 O = O 2 + 4NaOH (เดือด)
Na 2 O 2 + 2НCl (เจือจาง) = 2NaCl + Н 2 O 2 (เย็น)
2Na 2 O 2 + 4НCl (เจือจาง) = 4НCl + 2Н 2 O + O 2 (เดือด)
2นา 2 O 2 + 2CO 2 = นา 2 CO 3 + O 2
นา 2 O 2 + CO = นา 2 CO 3
นา 2 O 2 + 4H + + 2I - = ฉัน 2 ↓ + 2H 2 O + 2Na +
5นา 2 โอ 2 + 16H + + 2MnO 4 - = 5O 2 + 2Mn 2+ + 8H 2 O + 10Na +
3Na 2 O 2 + 2 3‑ = 2CrO 2 4‑ + 8OH ‑ + 2H 2 O + 6Na + (80 °C)
ใบเสร็จ:การเผาไหม้ของนาในอากาศ
โซเดียมไฮดรอกไซด์ NaOHไฮดรอกไซด์พื้นฐาน ด่าง ชื่อทางเทคนิค โซเดียมไฮดรอกไซด์ผลึกสีขาวที่มีโครงสร้างไอออนิก (Na +)(OH −) มันละลายในอากาศดูดซับความชื้นและคาร์บอนไดออกไซด์ (เกิด NaHCO 3) ละลายและเดือดโดยไม่สลายตัว ทำให้เกิดแผลไหม้อย่างรุนแรงต่อผิวหนังและดวงตา.
ละลายได้มากในน้ำ (ด้วย ภายนอก‐เอฟเฟกต์ +56 กิโลจูล) ทำปฏิกิริยากับกรดออกไซด์ ทำให้กรดเป็นกลาง ทำให้เกิดการทำงานของกรดในแอมโฟเทอริกออกไซด์และไฮดรอกไซด์:
NaOH (เจือจาง) + H 3 PO 4 (เข้มข้น) = NaH 2 PO 4 + H 2 O
2NaOH (ดิล.) + H 3 PO 4 (ดิล.) = นา 2 HPO 4 + 2H 2 O
3NaOH (เข้มข้น) + H 3 PO 4 (เจือจาง) = นา 3 PO 4 + 3H 2 O
2NaOH (T) + M 2 O 3 = 2NaMO 2 + H 2 O (1,000 °C, M = อัล, Cr)
2NaOH (เข้มข้น) + 3H 2 O + AI 2 O 3 = 2Na (เดือด)
2NaOH (T) + M(OH) 2 = นา 2 MO 2 + 2H 2 O (500 °C, M = Be, Zn)
2NaOH (เข้มข้น) + Zn(OH) 2 = นา 2
ตกตะกอนไฮดรอกไซด์ที่ไม่ละลายน้ำ:
2NaOH + MCl 2 = 2NaCl + M(OH) 2 ↓ (M = Mg, Cu)
สลายฮาโลเจนและซัลเฟอร์:
2NaOH (เข้มข้น เย็น) + E 2 = NaE + NaEO + H 2 O (E = Cl, Br)
6NaOH (ดิล., ฮ.) + 3S = 2Na 2 S + นา 2 SO 3 + 3H 2 O
ขึ้นอยู่กับกระแสไฟฟ้าในการหลอมละลาย:
สารละลาย NaOH กัดกร่อนแก้ว (เกิด NaSiO 3) และกัดกร่อนพื้นผิวอะลูมิเนียม (เกิด Na และ H 2)
ใบเสร็จ NaOH เข้า อุตสาหกรรม:
ก) อิเล็กโทรไลซิสของสารละลาย NaCl บนแคโทดเฉื่อย:
b) อิเล็กโทรไลซิสของสารละลาย NaCl บนแคโทดปรอท (วิธีอะมัลกัม):
(สารปรอทที่ปล่อยออกมาจะถูกส่งกลับไปยังเครื่องอิเล็กโตรไลเซอร์)
โซดาไฟเป็นวัตถุดิบที่สำคัญที่สุดของอุตสาหกรรมเคมี ใช้ในการผลิตเกลือโซเดียม เซลลูโลส สบู่ สีย้อม และเส้นใยประดิษฐ์ เป็นเครื่องอบแห้งด้วยแก๊ส รีเอเจนต์ในการนำดีบุกและสังกะสีกลับมาใช้ใหม่จากวัสดุรีไซเคิล เมื่อแปรรูปแร่อลูมิเนียม (บอกไซต์)
โพแทสเซียม– องค์ประกอบของคาบที่ 4 และกลุ่ม IA ของตารางธาตุ หมายเลขซีเรียล 19 สูตรอิเล็กทรอนิกส์ของอะตอม [ 18 Ar]4s 1 สถานะออกซิเดชัน +I และ 0 มีอิเล็กโตรเนกาติวีตี้ต่ำ (0.91) จัดแสดงโลหะ (พื้นฐาน) คุณสมบัติ. ก่อตัว (เป็นไอออนบวก) เกลือและสารประกอบไบนารีจำนวนมาก เกลือโพแทสเซียมเกือบทั้งหมดละลายได้ดีในน้ำ
ในธรรมชาติ - เก้าจากความอุดมสมบูรณ์ทางเคมี ธาตุ (อันดับที่ 6 ในบรรดาโลหะ) จะพบได้เฉพาะในรูปของสารประกอบเท่านั้น เป็นองค์ประกอบสำคัญสำหรับสิ่งมีชีวิตทุกชนิด
การขาดโพแทสเซียมในดินได้รับการชดเชยด้วยการใช้ปุ๋ยโพแทสเซียม - KCl คลอไรด์, ซัลเฟต K2SO4 และเถ้าพืช
โพแทสเซียม โพแทสเซียมไอออน และสารประกอบของโพแทสเซียมทำให้เปลวไฟของเตาแก๊สเป็นสีม่วง ( การตรวจสอบเชิงคุณภาพ)
โพแทสเซียมเคโลหะสีเงิน-ขาว เบา นุ่มมาก ละลายต่ำ เก็บโพแทสเซียมไว้ใต้ชั้นน้ำมันก๊าด ด้วยปรอทจะเกิดเป็นโลหะผสมเหลว - มัลกัม
คุณสมบัติทางเคมีของมันคล้ายกับโซเดียม แต่มีปฏิกิริยามากกว่า ในอากาศชื้น มันจะจางหายไป และถูกปกคลุมไปด้วยฟิล์มไฮดรอกไซด์
โพแทสเซียมแสดงคุณสมบัติการรีดิวซ์ที่รุนแรง มันเผาไหม้ในอากาศอย่างแข็งขันถึง KO 2 ทำปฏิกิริยากับไฮโดรเจน (ผลิตภัณฑ์ KH) คลอรีน (KCl) ซัลเฟอร์ (K 2 S)
มีพลังและสูง ภายนอก- ผลของโพแทสเซียมสลายน้ำ:
2K + 2H 2 O = 2KOH + H 2 + 392 กิโลจูล
ไฮโดรเจนที่ปล่อยออกมาจะติดไฟทันที
ในชุดแรงดันไฟฟ้าโพแทสเซียมจะอยู่ทางด้านซ้ายของไฮโดรเจนอย่างมีนัยสำคัญ จากกรดเจือจาง HCl และ H 2 SO 4 จะแทนที่ไฮโดรเจน (เนื่องจาก H 2 O และ H +) ในขณะที่กรดซัลฟิวริกจะลดลงบางส่วนเป็น SO 2
ใบเสร็จโพแทสเซียมใน อุตสาหกรรมเช่นเดียวกับการได้รับโซเดียม
โพแทสเซียมใช้สำหรับการสังเคราะห์สารประกอบ (KO 2, KH, เกลือ) ในรูปของการหลอม (ผสมกับ Na) - เป็นสารหล่อเย็นในเครื่องปฏิกรณ์นิวเคลียร์
โพแทสเซียมไฮดรอกไซด์ KOH.ไฮดรอกไซด์พื้นฐาน ด่าง ชื่อทางเทคนิค โปแตชกัดกร่อนสีขาว มีโครงสร้างไอออนิก K + OH - . ละลายและเดือดโดยไม่สลายตัว มันแพร่กระจายในอากาศและดูดซับคาร์บอนไดออกไซด์ (เกิด KHCO 3) ทำให้เกิดแผลไหม้อย่างรุนแรงต่อผิวหนังและดวงตา.
ละลายน้ำได้สูง (มีสูง ภายนอก- ผลกระทบ) สร้างสภาพแวดล้อมที่มีความเป็นด่างสูงในสารละลาย ทำให้เป็นกลางด้วยกรด ทำปฏิกิริยากับกรดออกไซด์ แอมโฟเทอริกไฮดรอกไซด์ และออกไซด์ สารละลายเข้มข้นกัดกร่อนแก้ว (เกิด K 2 SiO 3)
ปฏิกิริยาและวิธีการที่สำคัญที่สุดในการผลิต KOH ในอุตสาหกรรมนั้นคล้ายคลึงกับคุณสมบัติและการผลิต NaOH
KOH ใช้ในการผลิตสบู่เป็นตัวดูดซับก๊าซ สารทำให้ขาดน้ำ และสารตกตะกอนสำหรับไฮดรอกไซด์ของโลหะที่ไม่ละลายน้ำ
แคลเซียม– องค์ประกอบของคาบที่ 4 และหมู่ IIA ของตารางธาตุ เลขลำดับ 2O สูตรอิเล็กทรอนิกส์ของอะตอม [ 18 Ar]4s 2 , สถานะออกซิเดชัน +II และ 0 หมายถึงโลหะอัลคาไลน์เอิร์ธ
มีอิเลคโตรเนกาติวีตี้ต่ำ (1.04) และแสดงคุณสมบัติของโลหะ (พื้นฐาน) ก่อตัวเป็นเกลือและสารประกอบไบนารีจำนวนมาก (เป็นไอออนบวก) เกลือแคลเซียมหลายชนิดละลายได้ในน้ำเล็กน้อย
ในธรรมชาติ - ที่หกในแง่ของความอุดมสมบูรณ์ทางเคมี ธาตุ (อันดับที่ 3 ในบรรดาโลหะ) จะอยู่ในรูปแบบที่ถูกผูกไว้ เป็นองค์ประกอบสำคัญสำหรับสิ่งมีชีวิตทุกชนิด
การขาดแคลเซียมในดินจะชดเชยด้วยการเติม ปุ๋ยมะนาว(CaCO 3, CaO, แคลเซียมไซยานาไมด์ CaCN 2 ฯลฯ)
แคลเซียม แคลเซียมไอออนบวก และสารประกอบของแคลเซียมจะทำให้เปลวไฟของเตาแก๊สเป็นสีส้มเข้ม ( การตรวจสอบเชิงคุณภาพ)
แคลเซียม Ca.โลหะสีเงินสีขาว อ่อนนุ่ม เหนียว ในอากาศชื้น สารจะจางหายไปและปกคลุมไปด้วยฟิล์ม CaO และ Ca(OH) 2
มีปฏิกิริยามาก ติดไฟเมื่อได้รับความร้อนในอากาศ ทำปฏิกิริยากับไฮโดรเจน คลอรีน ซัลเฟอร์ และกราไฟท์:
ลดโลหะอื่นๆ จากออกไซด์ (วิธีการที่สำคัญทางอุตสาหกรรม - แคลเซียมเธอร์เจียม):
ZCa + Cr 2 O 3 = ZCaO + 2Cr (700–800 °C)
5Ca + V 2 O 5 = 5CaO + 2V (950 °C)
ทำปฏิกิริยาอย่างแรงกับน้ำ (มีค่าสูง ภายนอก-ผล):
Ca + 2H 2 O = Ca(OH) 2 + H 2 + 413 กิโลจูล
ในซีรีย์แรงดันไฟฟ้าจะอยู่ทางด้านซ้ายของไฮโดรเจนอย่างมีนัยสำคัญ โดยจะแทนที่ไฮโดรเจนจากกรดเจือจาง HCl และ H 2 SO 4 (เนื่องจาก H 2 O และ H +):
Ca + 2H+ = Ca 2+ + H 2
ใบเสร็จแคลเซียมเข้า อุตสาหกรรม:
แคลเซียมใช้ในการกำจัดสิ่งเจือปนที่ไม่ใช่โลหะออกจากโลหะผสม ซึ่งเป็นส่วนประกอบของโลหะผสมที่เบาและต้านการเสียดสี และเพื่อแยกโลหะหายากออกจากออกไซด์
แคลเซียมออกไซด์ CaOออกไซด์พื้นฐาน ชื่อทางเทคนิค ปูนขาว.ขาวดูดความชื้นมาก มีโครงสร้างไอออนิก: Ca 2+ O 2- ทนไฟ มีความเสถียรต่อความร้อน ระเหยง่ายเมื่อติดไฟ ดูดซับความชื้นและคาร์บอนไดออกไซด์จากอากาศ ทำปฏิกิริยาอย่างแรงกับน้ำ (มีค่าสูง ภายนอก‐เอฟเฟกต์) ทำให้เกิดสารละลายที่มีความเป็นด่างสูง (สามารถตกตะกอนไฮดรอกไซด์ได้) เรียกว่ากระบวนการ มะนาวทำปฏิกิริยากับกรด โลหะ และอโลหะออกไซด์ ใช้สำหรับการสังเคราะห์สารประกอบแคลเซียมอื่นๆ ในการผลิต Ca(OH) 2, CaC 2 และปุ๋ยแร่ธาตุ เป็นฟลักซ์ในโลหะวิทยา ตัวเร่งปฏิกิริยาในการสังเคราะห์สารอินทรีย์ และเป็นส่วนประกอบของวัสดุยึดเกาะในการก่อสร้าง
สมการของปฏิกิริยาที่สำคัญที่สุด:
ใบเสร็จ CaO เข้า อุตสาหกรรม– การเผาหินปูน (900–1200 °C):
แคลเซียมคาร์บอเนต 3 = เซา+ คาร์บอนไดออกไซด์ 2
แคลเซียมไฮดรอกไซด์ Ca(OH) 2ไฮดรอกไซด์พื้นฐาน ชื่อทางเทคนิค มะนาวสุกสีขาวดูดความชื้น. มีโครงสร้างไอออนิก: Ca 2+ (OH -) 2 สลายตัวเมื่อได้รับความร้อนปานกลาง ดูดซับความชื้นและคาร์บอนไดออกไซด์จากอากาศ ละลายได้เล็กน้อยในน้ำเย็น (เกิดสารละลายอัลคาไลน์) และละลายได้น้อยกว่าในน้ำเดือด สารละลายโปร่งใส ( น้ำมะนาว)กลายเป็นเมฆมากอย่างรวดเร็วเนื่องจากการตกตะกอนของไฮดรอกไซด์ตกตะกอน (เรียกว่าสารแขวนลอย นมมะนาว) ปฏิกิริยาเชิงคุณภาพสำหรับไอออน Ca 2+ - ส่งก๊าซคาร์บอนไดออกไซด์ผ่านน้ำมะนาวโดยมีลักษณะเป็นตะกอน CaCO 3 และเปลี่ยนเป็นสารละลาย ทำปฏิกิริยากับกรดและกรดออกไซด์ เข้าสู่ปฏิกิริยาแลกเปลี่ยนไอออน
มันถูกใช้ในการผลิตแก้ว, ปูนขาว, ปุ๋ยแร่มะนาว, สำหรับโซดาไฟและทำให้น้ำจืดอ่อนตัวลง, เช่นเดียวกับการเตรียมปูนขาว - ส่วนผสมคล้ายแป้ง (ทราย + ปูนขาว + น้ำ), ทำหน้าที่เป็นวัสดุยึดเกาะ สำหรับงานหินและอิฐ งานตกแต่ง (ฉาบปูน) ผนัง และวัตถุประสงค์ในการก่อสร้างอื่นๆ การแข็งตัว (“การตั้งค่า”) ของสารละลายดังกล่าวเกิดจากการดูดซับคาร์บอนไดออกไซด์จากอากาศ
สมการของปฏิกิริยาที่สำคัญที่สุด:
ใบเสร็จ Ca(OH) 2 นิ้ว อุตสาหกรรม– ปูนขาว CaO (ดูด้านบน)
5.4. ความกระด้างของน้ำ
น้ำธรรมชาติที่ไหลผ่านหินและดินที่เป็นปูน อุดมไปด้วยเกลือแคลเซียมและแมกนีเซียม (รวมถึงธาตุเหล็ก) และกลายเป็น ยาก.เมื่อซักเสื้อผ้าในน้ำกระด้าง ปริมาณการใช้สบู่จะเพิ่มขึ้น และผ้าที่ดูดซับเกลือจะกลายเป็นสีเหลืองและเสื่อมสภาพอย่างรวดเร็ว มาตราส่วน -สารประกอบที่ไม่ละลายน้ำของแคลเซียม แมกนีเซียม และเหล็กออกไซด์) สะสมอยู่บนผนังด้านในของจาน หม้อต้มไอน้ำ และท่อ ผัก ธัญพืช และเนื้อสัตว์ใช้เวลาปรุงในน้ำกระด้างนานกว่า แยกแยะ ชั่วคราวและ คงที่ความกระด้างของน้ำ
ความกระด้างชั่วคราวเกิดจากการมีไฮโดรคาร์บอเนต M(HCO 3) 2 (M = Ca, Mg) และ Fe(HCO 3) 2 อยู่ในน้ำ หากมีปริมาณเนื้อหาของ HCO 3 - ไอออนก็จะพูดถึง คาร์บอเนตความแข็งหากเนื้อหาของไอออน Ca 2+, Mg 2+ และ Fe 2+ เป็นเรื่องเกี่ยวกับ แคลเซียมแมกนีเซียมหรือ เหล็กความแข็งแกร่ง ความกระด้างชั่วคราวจะสูงขึ้น ปริมาณของไอออนเหล่านี้ในน้ำก็จะยิ่งสูงขึ้น ความกระด้างของน้ำเรียกว่าชั่วคราวเพราะสามารถกำจัดได้โดยการต้มง่ายๆ:
Ca(HCO 3) 2 = CaCO 3 ↓ + H 2 O + CO 2
มก.(HCO 3) 2 = มก.(OH) 2 ↓ + 2СO 2
4เฟ(HCO 3) 2 + O 2 = 2เฟ 2 โอ 3 ↓ + 8CO 2 + 4H 2 O
คงที่ความกระด้างเกิดจากเกลือแคลเซียมและแมกนีเซียมอื่นๆ (ซัลเฟต, คลอไรด์, ไนเตรต, ไดไฮโดรออร์โธฟอสเฟต ฯลฯ ) ความกระด้างนี้ไม่สามารถกำจัดได้ด้วยน้ำเดือด ดังนั้น ในการกำจัดเกลือส่วนใหญ่ออกจากน้ำกระด้าง จะต้องทำให้อ่อนตัวลงโดยใช้รีเอเจนต์เคมีและวิธีการพิเศษ (การแลกเปลี่ยนไอออน) น้ำอ่อนเหมาะสำหรับดื่มและปรุงอาหาร
การทำให้น้ำอ่อนตัวทำได้สำเร็จหากได้รับการบำบัดด้วยสารตกตะกอนต่างๆ - ปูนขาวโซดาและโซเดียมออร์โธฟอสเฟต:
การกำจัดความแข็งแกร่งชั่วคราว:
Ca(HCO 3) 2 + Ca(OH) 2 = 2CaCO 3 ↓ + 2H 2 O
Mg(HCO 3) 2 + Ca(OH) 2 = CaMg(CO 3) 2 ↓ + 2H 2 O
4Fe(HCO 3) 2 + 8Ca(OH) 2 + O 2 = 4FeO(OH)↓ + 8CaCO 3 ↓ + 10H 2 O
ขจัดความแข็งถาวร:
แคลเซียม(NO 3) 2 + นา 2 CO 3 = CaCO 3 ↓ + 2NaNO 3
2MgSO 4 + H 2 O = นา 2 CO 3 = Mg 2 CO 3 (OH) 2 ↓ + CO 2 + 2Na 2 SO 4
3FeCl 2 + 2Na 3 PO 4 = เฟ 3 (PO 4) 2 ↓ + 6NaCl
ในห้องปฏิบัติการเคมีและในอุตสาหกรรม มีการใช้น้ำปราศจากแร่ธาตุอย่างสมบูรณ์ (ไม่เหมาะสำหรับการดื่ม) เพื่อให้ได้น้ำที่แยกเกลือออก น้ำธรรมชาติจะต้องผ่านการกลั่น เช่น กลั่นน้ำก็นุ่มเหมือนน้ำฝน
แคลเซียม– องค์ประกอบของคาบที่ 4 และหมู่ IIA ของตารางธาตุ เลขลำดับ 2O สูตรอิเล็กทรอนิกส์ของอะตอม [ 18 Ar]4s 2 , สถานะออกซิเดชัน +II และ 0 หมายถึงโลหะอัลคาไลน์เอิร์ธ
มีอิเลคโตรเนกาติวีตี้ต่ำ (1.04) และแสดงคุณสมบัติของโลหะ (พื้นฐาน) ก่อตัวเป็นเกลือและสารประกอบไบนารีจำนวนมาก (เป็นไอออนบวก) เกลือแคลเซียมหลายชนิดละลายได้ในน้ำเล็กน้อย
ในธรรมชาติ - ที่หกในแง่ของความอุดมสมบูรณ์ทางเคมี ธาตุ (อันดับที่ 3 ในบรรดาโลหะ) จะอยู่ในรูปแบบที่ถูกผูกไว้ เป็นองค์ประกอบสำคัญสำหรับสิ่งมีชีวิตทุกชนิด
การขาดแคลเซียมในดินจะชดเชยด้วยการเติม ปุ๋ยมะนาว(CaCO 3, CaO, แคลเซียมไซยานาไมด์ CaCN 2 ฯลฯ)
แคลเซียม แคลเซียมไอออนบวก และสารประกอบของแคลเซียมจะทำให้เปลวไฟของเตาแก๊สเป็นสีส้มเข้ม ( การตรวจสอบเชิงคุณภาพ)
แคลเซียม Ca.โลหะสีเงินสีขาว อ่อนนุ่ม เหนียว ในอากาศชื้น สารจะจางหายไปและปกคลุมไปด้วยฟิล์ม CaO และ Ca(OH) 2
มีปฏิกิริยามาก ติดไฟเมื่อได้รับความร้อนในอากาศ ทำปฏิกิริยากับไฮโดรเจน คลอรีน ซัลเฟอร์ และกราไฟท์:
ลดโลหะอื่นๆ จากออกไซด์ (วิธีการที่สำคัญทางอุตสาหกรรม - แคลเซียมเธอร์เจียม):
ZCa + Cr 2 O 3 = ZCaO + 2Cr (700–800 °C)
5Ca + V 2 O 5 = 5CaO + 2V (950 °C)
ทำปฏิกิริยาอย่างแรงกับน้ำ (มีค่าสูง ภายนอก-ผล):
Ca + 2H 2 O = Ca(OH) 2 + H 2 + 413 กิโลจูล
ในซีรีย์แรงดันไฟฟ้าจะอยู่ทางด้านซ้ายของไฮโดรเจนอย่างมีนัยสำคัญ โดยจะแทนที่ไฮโดรเจนจากกรดเจือจาง HCl และ H 2 SO 4 (เนื่องจาก H 2 O และ H +):
Ca + 2H+ = Ca 2+ + H 2
ใบเสร็จแคลเซียมเข้า อุตสาหกรรม :
แคลเซียมใช้ในการกำจัดสิ่งเจือปนที่ไม่ใช่โลหะออกจากโลหะผสม ซึ่งเป็นส่วนประกอบของโลหะผสมที่เบาและต้านการเสียดสี และเพื่อแยกโลหะหายากออกจากออกไซด์
แคลเซียมออกไซด์ CaOออกไซด์พื้นฐาน ชื่อทางเทคนิค ปูนขาว.ขาวดูดความชื้นมาก มีโครงสร้างไอออนิก: Ca 2+ O 2- ทนไฟ มีความเสถียรต่อความร้อน ระเหยง่ายเมื่อติดไฟ ดูดซับความชื้นและคาร์บอนไดออกไซด์จากอากาศ ทำปฏิกิริยาอย่างแรงกับน้ำ (มีค่าสูง ภายนอก‐เอฟเฟกต์) ทำให้เกิดสารละลายที่มีความเป็นด่างสูง (สามารถตกตะกอนไฮดรอกไซด์ได้) เรียกว่ากระบวนการ มะนาวทำปฏิกิริยากับกรด โลหะ และอโลหะออกไซด์ ใช้สำหรับการสังเคราะห์สารประกอบแคลเซียมอื่นๆ ในการผลิต Ca(OH) 2, CaC 2 และปุ๋ยแร่ธาตุ เป็นฟลักซ์ในโลหะวิทยา ตัวเร่งปฏิกิริยาในการสังเคราะห์สารอินทรีย์ และเป็นส่วนประกอบของวัสดุยึดเกาะในการก่อสร้าง
สมการของปฏิกิริยาที่สำคัญที่สุด:
ใบเสร็จ CaO เข้า อุตสาหกรรม– การเผาหินปูน (900–1200 °C):
แคลเซียมคาร์บอเนต 3 = เซา+ คาร์บอนไดออกไซด์ 2
แคลเซียมไฮดรอกไซด์ Ca(OH) 2ไฮดรอกไซด์พื้นฐาน ชื่อทางเทคนิค มะนาวสุกสีขาวดูดความชื้น. มีโครงสร้างไอออนิก: Ca 2+ (OH -) 2 สลายตัวเมื่อได้รับความร้อนปานกลาง ดูดซับความชื้นและคาร์บอนไดออกไซด์จากอากาศ ละลายได้เล็กน้อยในน้ำเย็น (เกิดสารละลายอัลคาไลน์) และละลายได้น้อยกว่าในน้ำเดือด สารละลายโปร่งใส ( น้ำมะนาว)กลายเป็นเมฆมากอย่างรวดเร็วเนื่องจากการตกตะกอนของไฮดรอกไซด์ตกตะกอน (เรียกว่าสารแขวนลอย นมมะนาว) ปฏิกิริยาเชิงคุณภาพสำหรับไอออน Ca 2+ - ส่งก๊าซคาร์บอนไดออกไซด์ผ่านน้ำมะนาวโดยมีลักษณะเป็นตะกอน CaCO 3 และเปลี่ยนเป็นสารละลาย ทำปฏิกิริยากับกรดและกรดออกไซด์ เข้าสู่ปฏิกิริยาแลกเปลี่ยนไอออน
มันถูกใช้ในการผลิตแก้ว, ปูนขาว, ปุ๋ยแร่มะนาว, สำหรับโซดาไฟและทำให้น้ำจืดอ่อนตัวลง, เช่นเดียวกับการเตรียมปูนขาว - ส่วนผสมคล้ายแป้ง (ทราย + ปูนขาว + น้ำ), ทำหน้าที่เป็นวัสดุยึดเกาะ สำหรับงานหินและอิฐ งานตกแต่ง (ฉาบปูน) ผนัง และวัตถุประสงค์ในการก่อสร้างอื่นๆ การแข็งตัว (“การตั้งค่า”) ของสารละลายดังกล่าวเกิดจากการดูดซับคาร์บอนไดออกไซด์จากอากาศ
สมการของปฏิกิริยาที่สำคัญที่สุด:
ใบเสร็จ Ca(OH) 2 นิ้ว อุตสาหกรรม– ปูนขาว CaO (ดูด้านบน)
5.4. ความกระด้างของน้ำ
น้ำธรรมชาติที่ไหลผ่านหินและดินที่เป็นปูน อุดมไปด้วยเกลือแคลเซียมและแมกนีเซียม (รวมถึงธาตุเหล็ก) และกลายเป็น ยาก.เมื่อซักเสื้อผ้าในน้ำกระด้าง ปริมาณการใช้สบู่จะเพิ่มขึ้น และผ้าที่ดูดซับเกลือจะกลายเป็นสีเหลืองและเสื่อมสภาพอย่างรวดเร็ว มาตราส่วน -สารประกอบที่ไม่ละลายน้ำของแคลเซียม แมกนีเซียม และเหล็กออกไซด์) สะสมอยู่บนผนังด้านในของจาน หม้อต้มไอน้ำ และท่อ ผัก ธัญพืช และเนื้อสัตว์ใช้เวลาปรุงในน้ำกระด้างนานกว่า แยกแยะ ชั่วคราวและ คงที่ความกระด้างของน้ำ
ความกระด้างชั่วคราวเกิดจากการมีไฮโดรคาร์บอเนต M(HCO 3) 2 (M = Ca, Mg) และ Fe(HCO 3) 2 อยู่ในน้ำ หากมีปริมาณเนื้อหาของ HCO 3 - ไอออนก็จะพูดถึง คาร์บอเนตความแข็งหากเนื้อหาของไอออน Ca 2+, Mg 2+ และ Fe 2+ เป็นเรื่องเกี่ยวกับ แคลเซียมแมกนีเซียมหรือ เหล็กความแข็งแกร่ง ความกระด้างชั่วคราวจะสูงขึ้น ปริมาณของไอออนเหล่านี้ในน้ำก็จะยิ่งสูงขึ้น ความกระด้างของน้ำเรียกว่าชั่วคราวเพราะสามารถกำจัดได้โดยการต้มง่ายๆ:
Ca(HCO 3) 2 = CaCO 3 ↓ + H 2 O + CO 2
มก.(HCO 3) 2 = มก.(OH) 2 ↓ + 2СO 2
4เฟ(HCO 3) 2 + O 2 = 2เฟ 2 โอ 3 ↓ + 8CO 2 + 4H 2 O
คงที่ความกระด้างเกิดจากเกลือแคลเซียมและแมกนีเซียมอื่นๆ (ซัลเฟต, คลอไรด์, ไนเตรต, ไดไฮโดรออร์โธฟอสเฟต ฯลฯ ) ความกระด้างนี้ไม่สามารถกำจัดได้ด้วยน้ำเดือด ดังนั้น ในการกำจัดเกลือส่วนใหญ่ออกจากน้ำกระด้าง จะต้องทำให้อ่อนตัวลงโดยใช้รีเอเจนต์เคมีและวิธีการพิเศษ (การแลกเปลี่ยนไอออน) น้ำอ่อนเหมาะสำหรับดื่มและปรุงอาหาร
การทำให้น้ำอ่อนตัวทำได้สำเร็จหากได้รับการบำบัดด้วยสารตกตะกอนต่างๆ - ปูนขาวโซดาและโซเดียมออร์โธฟอสเฟต:
การกำจัดความแข็งแกร่งชั่วคราว:
Ca(HCO 3) 2 + Ca(OH) 2 = 2CaCO 3 ↓ + 2H 2 O
Mg(HCO 3) 2 + Ca(OH) 2 = CaMg(CO 3) 2 ↓ + 2H 2 O
4Fe(HCO 3) 2 + 8Ca(OH) 2 + O 2 = 4FeO(OH)↓ + 8CaCO 3 ↓ + 10H 2 O
ขจัดความแข็งถาวร:
แคลเซียม(NO 3) 2 + นา 2 CO 3 = CaCO 3 ↓ + 2NaNO 3
2MgSO 4 + H 2 O = นา 2 CO 3 = Mg 2 CO 3 (OH) 2 ↓ + CO 2 + 2Na 2 SO 4
3FeCl 2 + 2Na 3 PO 4 = เฟ 3 (PO 4) 2 ↓ + 6NaCl
ในห้องปฏิบัติการเคมีและในอุตสาหกรรม มีการใช้น้ำปราศจากแร่ธาตุอย่างสมบูรณ์ (ไม่เหมาะสำหรับการดื่ม) เพื่อให้ได้น้ำที่แยกเกลือออก น้ำธรรมชาติจะต้องผ่านการกลั่น เช่น กลั่นน้ำก็นุ่มเหมือนน้ำฝน
เราจะทำอย่างไรกับเนื้อหาที่ได้รับ:
หากเนื้อหานี้มีประโยชน์สำหรับคุณ คุณสามารถบันทึกลงในเพจของคุณบนโซเชียลเน็ตเวิร์ก:
| ทวีต |
หัวข้อทั้งหมดในส่วนนี้:
องค์ประกอบทั่วไป โครงสร้างของอะตอม เปลือกอิเล็กทรอนิกส์ วงโคจร
องค์ประกอบทางเคมีคืออะตอมประเภทหนึ่งที่กำหนดโดยชื่อและสัญลักษณ์ และแสดงคุณลักษณะด้วยเลขอะตอมและมวลอะตอมสัมพัทธ์
ในตาราง 1 รายการ
แต่ละวงโคจรสามารถรองรับอิเล็กตรอนได้ไม่เกินสองตัว
อิเล็กตรอนหนึ่งตัวในวงโคจรเรียกว่าคู่อิเล็กตรอน อิเล็กตรอนสองตัวเรียกว่าคู่อิเล็กตรอน:
คุณสมบัติขององค์ประกอบจะขึ้นอยู่กับเลขลำดับเป็นระยะ
ธรรมชาติของการเปลี่ยนแปลงที่เกิดขึ้นซ้ำ ๆ เป็นระยะ ๆ ในองค์ประกอบของเปลือกอิเล็กทรอนิกส์ของอะตอมขององค์ประกอบจะอธิบายการเปลี่ยนแปลงคุณสมบัติขององค์ประกอบเป็นระยะเมื่อเคลื่อนที่ผ่านช่วงเวลาและกลุ่มของ Pe
โมเลกุล พันธะเคมี โครงสร้างของสาร
อนุภาคเคมีที่เกิดจากอะตอมสองอะตอมขึ้นไปเรียกว่าโมเลกุล (หน่วยสูตรจริงหรือทั่วไปของสารโพลีอะตอมมิก) อะตอมมีหน่วยเป็นโมล
อลูมิเนียม
อะลูมิเนียมเป็นองค์ประกอบของคาบที่ 3 และกลุ่ม IIIA ของระบบธาตุ หมายเลขซีเรียล 13 สูตรอิเล็กทรอนิกส์ของอะตอมคือ 3s23p1
แมงกานีส
แมงกานีสเป็นองค์ประกอบของคาบที่ 4 และกลุ่ม VIIB ของตารางธาตุ หมายเลขซีเรียล 25 สูตรทางอิเล็กทรอนิกส์ของอะตอมคือ 3d54s2;
คุณสมบัติทั่วไปของโลหะ การกัดกร่อน
องค์ประกอบที่มีคุณสมบัติเป็นโลหะอยู่ในกลุ่ม IA – VIA ของตารางธาตุ (ตารางที่ 7)
ไฮโดรเจน
ไฮโดรเจนเป็นองค์ประกอบแรกของตารางธาตุ (คาบที่ 1 เลขลำดับ 1) ไม่มีความคล้ายคลึงอย่างสมบูรณ์กับองค์ประกอบทางเคมีอื่น ๆ และไม่ได้อยู่ในกลุ่มใด ๆ
คลอรีน. ไฮโดรเจนคลอไรด์
คลอรีนเป็นองค์ประกอบของคาบที่ 3 และกลุ่ม VII A ของระบบธาตุ หมายเลขซีเรียล 17 สูตรอิเล็กทรอนิกส์ของอะตอม 3s23p5, ha
คลอไรด์
โซเดียมคลอไรด์ NaCl เกลือที่ปราศจากออกซิเจน ชื่อสามัญคือเกลือแกง สีขาว ดูดความชื้นได้เล็กน้อย ละลายและเดือดโดยไม่สลายตัว ละลายในระดับปานกลาง
ไฮโปคลอไรต์ คลอเรต
แคลเซียมไฮโปคลอไรต์ Ca(ClO)2 เกลือกรดไฮโปคลอรัส HClO สีขาว สลายตัวเมื่อได้รับความร้อนโดยไม่ละลาย ละลายได้ในน้ำเย็น (arr.
โบรไมด์. ไอโอไดด์
โพแทสเซียมโบรไมด์ KBr. เกลือที่ปราศจากออกซิเจน สีขาว ไม่ดูดความชื้น ละลายโดยไม่สลายตัว ละลายน้ำได้สูง ไม่มีการไฮโดรไลซิส สารรีดิวซ์ (อ่อนกว่า, h
ออกซิเจน
ออกซิเจนเป็นองค์ประกอบของคาบที่ 2 และกลุ่ม VIA ของตารางธาตุหมายเลข 8 เป็นของคาลโคเจน (แต่มักพิจารณาแยกกันมากกว่า) อิเล็กทรอนิกส์สำหรับ
กำมะถัน. ไฮโดรเจนซัลไฟด์ ซัลไฟด์
ซัลเฟอร์เป็นองค์ประกอบของคาบที่ 3 และกลุ่ม VIA ของตารางธาตุ เลขลำดับ 16 และเป็นของกลุ่มคาลโคเจน สูตรอิเล็กทรอนิกส์ของอะตอม 3s
ซัลเฟอร์ไดออกไซด์ SO2 ออกไซด์ที่เป็นกรด ก๊าซไม่มีสีมีกลิ่นฉุน โมเลกุลมีโครงสร้างเป็นรูปสามเหลี่ยมที่ไม่สมบูรณ์ [: S(O)2] (sp
กรดซัลฟูริก ซัลเฟต
กรดซัลฟิวริก H2SO4 ออกโซแอซิด ของเหลวไม่มีสี หนืดมาก (มัน) ดูดความชื้นได้มาก โมเลก
ไนโตรเจน แอมโมเนีย
ไนโตรเจนเป็นองค์ประกอบของคาบที่ 2 และหมู่ VA ของระบบธาตุ หมายเลขลำดับ 7 สูตรอิเล็กทรอนิกส์ของอะตอมคือ 2s22p3 ตัวอักษร
ไนโตรเจนออกไซด์ กรดไนตริก
ไนโตรเจนมอนอกไซด์NO. ออกไซด์ที่ไม่เกิดเกลือ ก๊าซไม่มีสี Radical ประกอบด้วยพันธะโควาเลนต์ σπ-bond (N=O) ในไดเมอร์สถานะของแข็ง N2
ไนไตรต์ ไนเตรต
โพแทสเซียมไนไตรท์KNO2. ออกโซโซล. สีขาวดูดความชื้น. ละลายโดยไม่สลายตัว มีเสถียรภาพในอากาศแห้ง ละลายได้มากในน้ำ (ไม่มีสี
ฟรีคาร์บอน
คาร์บอนเป็นองค์ประกอบของคาบที่ 2 และหมู่ IVA ของตารางธาตุ เลขลำดับ 6 เคมีของคาร์บอนส่วนใหญ่เป็นเคมีของสารประกอบอินทรีย์ อนินทรีย์
คาร์บอนออกไซด์
คาร์บอนมอนอกไซด์ CO ออกไซด์ที่ไม่เกิดเกลือ ก๊าซไม่มีสี ไม่มีกลิ่น เบากว่าอากาศ โมเลกุลมีขั้วอ่อน ประกอบด้วยโควาเลนต์สามσππ
คาร์บอเนต
โซเดียมคาร์บอเนต Na2CO3 ออกโซโซล. ชื่อทางเทคนิค: โซดาแอช สีขาว ละลายและสลายตัวเมื่อถูกความร้อน ความรู้สึก
ซิลิคอน
ซิลิคอนเป็นองค์ประกอบของคาบที่ 3 และกลุ่ม IVA ของตารางธาตุ เลขลำดับ 14 สูตรทางอิเล็กทรอนิกส์ของอะตอมคือ 3s23p2 เอ็กซ์
อัลเคน ไซโคลอัลเคน
อัลเคน (พาราฟิน) เป็นสารประกอบของคาร์บอนกับไฮโดรเจน ในโมเลกุลที่อะตอมของคาร์บอนเชื่อมต่อกันด้วยพันธะเดี่ยว (ไฮโดรคาร์บอนอิ่มตัว
อัลคีเนส อัลคาเดียนส์
อัลคีน (โอเลฟินส์) เป็นไฮโดรคาร์บอนที่มีโมเลกุลประกอบด้วยอะตอมของคาร์บอนเชื่อมต่อกันด้วยพันธะคู่ (ชุดไฮโดรคาร์บอนไม่อิ่มตัว)
แอลกอฮอล์ อีเทอร์ ฟีนอล
แอลกอฮอล์เป็นอนุพันธ์ของไฮโดรคาร์บอนที่มีหมู่ฟังก์ชัน OH (ไฮดรอกซิล) แอลกอฮอล์ที่มีหมู่ OH หนึ่งหมู่เรียกว่าโมโนแอต
อัลดีไฮด์และคีโตน
อัลดีไฮด์และคีโตนเป็นอนุพันธ์ของไฮโดรคาร์บอนที่มีกลุ่มฟังก์ชันคาร์บอนิล CO ในอัลดีไฮด์ หมู่คาร์บอนิลจะเกิดพันธะกับ a
กรดคาร์บอกซิลิก เอสเทอร์ ไขมัน
กรดคาร์บอกซิลิกเป็นอนุพันธ์ของไฮโดรคาร์บอนที่มีหมู่ฟังก์ชัน COOH (คาร์บอกซิล)
สูตรและชื่อเรียกทั่วไปบางคำ
คาร์โบไฮเดรต
คาร์โบไฮเดรต (น้ำตาล) เป็นสารประกอบธรรมชาติที่สำคัญที่สุดซึ่งประกอบด้วยคาร์บอน ไฮโดรเจน และออกซิเจน คาร์โบไฮเดรตแบ่งออกเป็นโมโนแซ็กคาไรด์ ไดแซ็กคาไรด์ และโพลีแซ็กคาไรด์
สารอินทรีย์ที่มีไนโตรเจนมีความสำคัญอย่างยิ่งต่อเศรษฐกิจของประเทศ ไนโตรเจนสามารถมีอยู่ในสารประกอบอินทรีย์ในรูปของกลุ่มไนโตร NO2 หมู่อะมิโน NH2 และ
กรดอะมิโน กระรอก
กรดอะมิโนเป็นสารประกอบอินทรีย์ที่มีหมู่ฟังก์ชันสองหมู่ ได้แก่ กรด COOH และเอมีน NH2
ความเร็วของปฏิกิริยา
ลักษณะเชิงปริมาณของความเร็วของปฏิกิริยาเคมี A + B → D + E คือความเร็วนั่นคือ ความเร็วของปฏิกิริยาของอนุภาคของรีเอเจนต์ A
อัตราของปฏิกิริยาเคมีเป็นสัดส่วนโดยตรงกับผลคูณของความเข้มข้นของโมลของสารตั้งต้น
ถ้าปฏิกิริยาต้องเกิดการชนกันของโมเลกุลที่ทำปฏิกิริยา 2 โมเลกุล การพึ่งพาอาศัยกันนี้เรียกว่ากฎจลน์ของการกระทำของมวล (K. Gullberg, P. Vogue
พลังงานของปฏิกิริยา
ปฏิกิริยาใด ๆ จะมาพร้อมกับการปล่อยหรือการดูดซับพลังงานในรูปของความร้อน ในสารตั้งต้น พันธะเคมีจะถูกทำลายและใช้พลังงานไปกับสิ่งนี้ (เช่น
การย้อนกลับของปฏิกิริยา
ปฏิกิริยาเคมีเรียกว่าปฏิกิริยาย้อนกลับได้หากภายใต้เงื่อนไขที่กำหนด ไม่เพียงแต่เกิดปฏิกิริยาโดยตรง (→) เท่านั้น แต่ยังเกิดปฏิกิริยาย้อนกลับด้วย เช่น สารตั้งต้นก่อตัว
เมื่อระบบสมดุลถูกเปิดออก สมดุลเคมีจะเลื่อนไปทางด้านที่ต้านผลกระทบนี้
ให้เราพิจารณารายละเอียดเพิ่มเติมเกี่ยวกับอิทธิพลของปัจจัยต่างๆ เช่น อุณหภูมิ ความดัน ความเข้มข้นที่มีต่อการเปลี่ยนแปลงของสมดุล
1. อุณหภูมิ อุณหภูมิเพิ่มขึ้น
ความสามารถในการละลายของสารในน้ำ
สารละลายคือระบบที่เป็นเนื้อเดียวกันซึ่งประกอบด้วยสารตั้งแต่ 2 ชนิดขึ้นไป ซึ่งเนื้อหาสามารถเปลี่ยนแปลงได้ภายในขีดจำกัดที่กำหนดโดยไม่รบกวนความเป็นเนื้อเดียวกัน
การแยกตัวด้วยไฟฟ้า
การละลายของสารใดๆ ในน้ำจะเกิดพร้อมกับการก่อตัวของไฮเดรต หากในเวลาเดียวกันไม่มีการเปลี่ยนแปลงสูตรเกิดขึ้นในอนุภาคของสารที่ละลายในสารละลายแสดงว่าสารดังกล่าว
การแยกตัวของน้ำ สารละลายขนาดกลาง
น้ำนั้นเป็นอิเล็กโทรไลต์ที่อ่อนแอมาก:
ปฏิกิริยาการแลกเปลี่ยนไอออน
ในสารละลายอิเล็กโทรไลต์เจือจาง (กรด, เบส, เกลือ) ปฏิกิริยาเคมีมักเกิดขึ้นเมื่อไอออนมีส่วนร่วม ในกรณีนี้ องค์ประกอบทั้งหมดของรีเอเจนต์สามารถรักษาไว้ได้
ไฮโดรไลซิสของเกลือ
การไฮโดรไลซิสของเกลือคือปฏิกิริยาระหว่างไอออนกับน้ำ ทำให้เกิดสภาพแวดล้อมที่เป็นกรดหรือด่าง แต่ไม่เกิดตะกอนหรือก๊าซตามมาด้วย (ด้านล่าง
สารออกซิไดซ์และสารรีดิวซ์
ปฏิกิริยารีดอกซ์เกิดขึ้นพร้อมกับการเพิ่มขึ้นและลดลงในสถานะออกซิเดชันขององค์ประกอบพร้อมกันและมาพร้อมกับการถ่ายโอนอิเล็กตรอน:
วิธีการนี้ประกอบด้วยหลายขั้นตอน
1. เขียนโครงร่างปฏิกิริยา ค้นหาองค์ประกอบที่เพิ่มและลดสถานะออกซิเดชันและขมขื่น
ช่วงความเค้นของโลหะ
ในชุดของความเค้นของโลหะ ลูกศรจะสอดคล้องกับความสามารถในการรีดิวซ์ของโลหะที่ลดลงและความสามารถในการออกซิไดซ์ของแคตไอออนที่เพิ่มขึ้นในสารละลายที่เป็นน้ำ (สภาพแวดล้อมที่เป็นกรด):
อิเล็กโทรไลซิสของการหลอมและสารละลาย
อิเล็กโทรไลซิสเป็นกระบวนการรีดอกซ์ที่เกิดขึ้นบนอิเล็กโทรดเมื่อกระแสไฟฟ้าตรงผ่านสารละลายหรือ
เศษส่วนมวลของตัวถูกละลาย การเจือจาง ความเข้มข้น และการผสมสารละลาย
เศษส่วนมวลของสารที่ละลาย B (ω in) คืออัตราส่วนของมวลของสาร B (t in) ต่อมวลของสารละลาย (m (p)
อัตราส่วนปริมาตรก๊าซ
สำหรับปฏิกิริยาเคมี a A + b B = c C + d D ความสัมพันธ์จะเป็นที่พอใจ
มวล (ปริมาตร ปริมาณของสาร) ของผลิตภัณฑ์โดยแยกตามรีเอเจนต์ที่มากเกินไปหรือมีสิ่งเจือปน
ส่วนเกินและการขาดรีเอเจนต์ ปริมาณ มวล และปริมาตร (สำหรับก๊าซ) ของรีเอเจนต์ไม่ได้คำนึงถึงปริมาณสัมพันธ์เสมอไป กล่าวคือ ตามสมการของปฏิกิริยา ชม
การหาสูตรโมเลกุลของสารประกอบอินทรีย์
เมื่อได้สูตรของสาร โดยเฉพาะในเคมีอินทรีย์ มักใช้ความหนาแน่นสัมพัทธ์ของก๊าซ
แคลเซียมความหนาแน่นของก๊าซสัมพัทธ์ X – อัตราส่วนของความหนาแน่นสัมบูรณ์
มันประกอบขึ้นเป็นโครงกระดูก แต่ร่างกายไม่สามารถสร้างธาตุนั้นขึ้นมาเองได้ เรากำลังพูดถึงแคลเซียม ผู้หญิงและผู้ชายที่เป็นผู้ใหญ่จำเป็นต้องได้รับโลหะอัลคาไลน์เอิร์ธอย่างน้อย 800 มิลลิกรัมต่อวัน สามารถสกัดได้จากข้าวโอ๊ต เฮเซลนัท นม ข้าวบาร์เลย์ ครีมเปรี้ยว ถั่ว และอัลมอนด์
ยังพบในถั่ว มัสตาร์ด และคอทเทจชีส จริงอยู่ หากคุณรวมพวกมันเข้ากับขนมหวาน กาแฟ โคล่า และอาหารที่อุดมด้วยกรดออกซาลิก การย่อยได้ของธาตุนั้นจะลดลง สภาพแวดล้อมในกระเพาะอาหารจะกลายเป็นด่าง แคลเซียมจะถูกจับในรูปแบบที่ไม่ละลายน้ำและถูกขับออกจากร่างกาย กระดูกและฟันเริ่มแตกหัก ธาตุนี้เกี่ยวข้องกับอะไร เนื่องจากมันได้กลายเป็นหนึ่งในสิ่งที่สำคัญที่สุดสำหรับสิ่งมีชีวิต และมีประโยชน์อะไรกับสารภายนอกสิ่งมีชีวิตของพวกมันบ้าง?เคมีภัณฑ์และ
คุณสมบัติทางกายภาพ
แคลเซียมตามธรรมชาติแล้วเป็นโลหะอัลคาไลน์เอิร์ธ ซึ่งหมายความว่าธาตุในรูปแบบบริสุทธิ์จะมีสีขาวเงิน แวววาว และสว่าง ความแข็งของโลหะอัลคาไลน์เอิร์ธสูงกว่าโลหะอัลคาไล
ตัวบ่งชี้แคลเซียมอยู่ที่ประมาณ 3 จุดตาม เช่น ยิปซั่มมีความแข็งเท่ากัน องค์ประกอบที่ 20 สามารถตัดด้วยมีดได้ แต่จะยากกว่าโลหะอัลคาไลธรรมดาใดๆ มาก
ความหมายของชื่อ “ดินอัลคาไลน์” คืออะไร? นี่คือวิธีที่นักเล่นแร่แปรธาตุตั้งชื่อแคลเซียมและโลหะอื่น ๆ ในกลุ่มของเขา พวกเขาเรียกออกไซด์ของธาตุโลก ออกไซด์ของสาร กลุ่มแคลเซียมให้สภาพแวดล้อมที่เป็นด่างแก่น้ำ
อย่างไรก็ตาม เรเดียม แบเรียม เช่นเดียวกับธาตุที่ 20 ไม่เพียงแต่จะพบเมื่อรวมกับออกซิเจนเท่านั้น มีเกลือแคลเซียมมากมายในธรรมชาติ ที่มีชื่อเสียงที่สุดคือแร่แคลไซต์ โลหะในรูปแบบคาร์บอนไดออกไซด์คือชอล์ก หินปูน และยิปซั่มที่รู้จักกันดี แต่ละคนก็มี แคลเซียมคาร์บอเนต.
ธาตุที่ 20 ก็มีสารประกอบระเหยเช่นกัน พวกเขาระบายสีเปลวไฟสีส้มแดงซึ่งกลายเป็นหนึ่งในเครื่องหมายในการระบุสาร
โลหะอัลคาไลน์เอิร์ธทุกชนิดเผาไหม้ได้ง่าย เพื่อให้แคลเซียมทำปฏิกิริยากับออกซิเจนก็เพียงพอแล้ว สภาวะปกติ- มีเพียงธรรมชาติเท่านั้นที่ธาตุนี้ไม่พบในรูปแบบบริสุทธิ์ แต่จะพบได้ในสารประกอบเท่านั้น

แคลเซียมออกซี- ฟิล์มที่หุ้มโลหะเมื่อสัมผัสกับอากาศ สารเคลือบมีสีเหลือง มันไม่เพียงแต่ประกอบด้วยออกไซด์มาตรฐานเท่านั้น แต่ยังมีเปอร์ออกไซด์และไนไตรด์อีกด้วย หากแคลเซียมอยู่ในน้ำมากกว่าในอากาศ แคลเซียมจะเข้าไปแทนที่ไฮโดรเจน
ในกรณีนี้จะเกิดการตกตะกอน - แคลเซียมไฮดรอกไซด์- โลหะบริสุทธิ์ที่ตกค้างจะลอยขึ้นสู่พื้นผิวโดยถูกผลักโดยฟองไฮโดรเจน รูปแบบเดียวกันนี้ใช้ได้กับกรด ตัวอย่างเช่นกรดไฮโดรคลอริกจะตกตะกอน แคลเซียมคลอไรด์และไฮโดรเจนก็ถูกปล่อยออกมา
ปฏิกิริยาบางอย่างต้องใช้อุณหภูมิที่สูงขึ้น ถ้ามันสูงถึง 842 องศา แคลเซียมก็เป็นไปได้ละลาย. ที่อุณหภูมิ 1,484 องศาเซลเซียส โลหะจะเดือด
สารละลายแคลเซียมเปรียบเสมือนธาตุบริสุทธิ์นำความร้อนได้ดีและ กระแสไฟฟ้า- แต่หากสารได้รับความร้อนมาก คุณสมบัติของโลหะก็จะหายไป นั่นคือไม่มีแคลเซียมที่หลอมละลายหรือเป็นก๊าซ
ในร่างกายมนุษย์ ธาตุมีอยู่ทั้งของแข็งและของเหลว สถานะของการรวมตัว- นุ่มนวลขึ้น น้ำแคลเซียมซึ่งมีอยู่ในนั้นสามารถทนได้ง่ายกว่า พบเพียง 1% ของสารอันดับที่ 20 นอกกระดูก
อย่างไรก็ตามการขนส่งผ่านเนื้อเยื่อมีบทบาทสำคัญ แคลเซียมในเลือดควบคุมการหดตัวของกล้ามเนื้อ รวมถึงหัวใจ และรักษาความดันโลหิตให้เป็นปกติ
การใช้แคลเซียม
ในรูปแบบบริสุทธิ์ จะใช้โลหะเป็นส่วนประกอบ พวกเขาไปที่กริดแบตเตอรี่ การมีแคลเซียมในโลหะผสมช่วยลดการคายประจุของแบตเตอรี่ได้ 10-13% นี่เป็นสิ่งสำคัญอย่างยิ่งสำหรับโมเดลที่อยู่กับที่ ตลับลูกปืนยังทำจากส่วนผสมของตะกั่วและองค์ประกอบ 20 โลหะผสมชนิดหนึ่งเรียกว่าโลหะผสมแบริ่ง

ในภาพเป็นผลิตภัณฑ์ที่มีแคลเซียม
โลหะอัลคาไลน์เอิร์ธถูกเติมลงในเหล็กเพื่อขจัดสิ่งเจือปนของกำมะถันออกจากโลหะผสม คุณสมบัติรีดิวซ์ของแคลเซียมยังมีประโยชน์ในการผลิตยูเรเนียม โครเมียม ซีเซียม รูบิเดียม เป็นต้น
แคลเซียมอะไร.ใช้ในโลหะวิทยาเหล็ก? ยังสะอาดเหมือนเดิม ความแตกต่างอยู่ที่จุดประสงค์ขององค์ประกอบ ตอนนี้เขามีบทบาท นี่คือสารเติมแต่งสำหรับโลหะผสมซึ่งจะช่วยลดอุณหภูมิของการก่อตัวและอำนวยความสะดวกในการแยกตะกรัน เม็ดแคลเซียมเทลงในอุปกรณ์สูญญากาศไฟฟ้าเพื่อขจัดร่องรอยของอากาศออกจากอุปกรณ์
ไอโซโทปแคลเซียมลำดับที่ 48 เป็นที่ต้องการในสถานประกอบการนิวเคลียร์ มีการผลิตองค์ประกอบที่หนักยิ่งยวดที่นั่น วัตถุดิบได้มาจากเครื่องเร่งปฏิกิริยานิวเคลียร์ พวกมันถูกเร่งด้วยความช่วยเหลือของไอออนซึ่งเป็นโพรเจกไทล์ชนิดหนึ่ง หาก Ca48 มีบทบาท ประสิทธิภาพในการสังเคราะห์จะเพิ่มขึ้นหลายร้อยเท่าเมื่อเทียบกับการใช้ไอออนของสารอื่นๆ
ในทางทัศนศาสตร์ องค์ประกอบที่ 20 มีค่าเป็นสารประกอบ แคลเซียมฟลูออไรด์และทังสเตนกลายเป็นเลนส์ วัตถุประสงค์ และปริซึมของเครื่องมือทางดาราศาสตร์ แร่ธาตุยังพบได้ในเทคโนโลยีเลเซอร์

นักธรณีวิทยาเรียกแคลเซียมฟลูออไรด์ฟลูออไรต์และทังสเตน - ชีไลต์ สำหรับอุตสาหกรรมด้านการมองเห็นนั้น จะมีการเลือกใช้คริสตัลเดี่ยว ซึ่งก็คือ ยูนิตขนาดใหญ่แต่ละยูนิตที่มีโครงตาข่ายต่อเนื่องกันและมีรูปร่างที่ชัดเจน
ในทางการแพทย์ไม่ใช่โลหะบริสุทธิ์ที่กำหนด แต่เป็นสารที่มีพื้นฐานมาจากโลหะนั้น ร่างกายดูดซึมได้ง่ายขึ้น แคลเซียมกลูโคเนต– วิธีการรักษาที่ถูกที่สุดใช้สำหรับโรคกระดูกพรุน ยา" แคลเซียม แมกนีเซียม» กำหนดไว้สำหรับวัยรุ่น สตรีมีครรภ์ และผู้สูงอายุ
พวกเขาต้องการผลิตภัณฑ์เสริมอาหารเพื่อตอบสนองความต้องการที่เพิ่มขึ้นของร่างกายสำหรับธาตุที่ 20 และเพื่อหลีกเลี่ยงโรคทางพัฒนาการ ควบคุมการเผาผลาญแคลเซียมฟอสฟอรัส “แคลเซียม ดี3”- ชื่อผลิตภัณฑ์ “D3” บ่งบอกว่ามีวิตามินดีอยู่ในนั้น เป็นของหายาก แต่จำเป็นสำหรับการดูดซึมโดยสมบูรณ์ แคลเซียม.
คำแนะนำถึง "แคลเซียม นิโคเมด3"บ่งชี้ว่ายาเป็นขององค์ประกอบทางเภสัชกรรมที่มีฤทธิ์รวมกัน เดียวกันที่มีการกล่าวถึง แคลเซียมคลอไรด์- ไม่เพียงเติมเต็มการขาดธาตุที่ 20 เท่านั้น แต่ยังช่วยประหยัดจากความมึนเมาและยังสามารถทดแทนพลาสมาในเลือดได้อีกด้วย ในสภาวะทางพยาธิวิทยาบางอย่างอาจจำเป็น
ยานี้ยังมีอยู่ในร้านขายยา แคลเซียมเป็นกรดวิตามินซี" คู่นี้กำหนดไว้ในระหว่างตั้งครรภ์และให้นมบุตร วัยรุ่นยังต้องการอาหารเสริม
การขุดแคลเซียม
แคลเซียมในอาหารแร่ธาตุ สารประกอบที่มนุษย์รู้จักมาตั้งแต่สมัยโบราณ โลหะถูกแยกออกมาในรูปแบบบริสุทธิ์เฉพาะในปี 1808 ฟอร์จูนยิ้มให้ฮัมฟรีย์ เดวี่ นักฟิสิกส์ชาวอังกฤษสกัดแคลเซียมโดยอิเล็กโทรไลซิสของเกลือหลอมเหลวของธาตุ วิธีนี้ยังคงใช้อยู่ในปัจจุบัน

อย่างไรก็ตาม นักอุตสาหกรรมมักหันไปใช้วิธีที่สองซึ่งค้นพบหลังจากการวิจัยของฮัมฟรีย์ แคลเซียมจะลดลงจากออกไซด์ บางครั้งปฏิกิริยาจะเริ่มต้นด้วยผง ปฏิกิริยาจะเกิดขึ้นภายใต้สภาวะสุญญากาศที่อุณหภูมิสูงขึ้น แคลเซียมถูกแยกได้ครั้งแรกด้วยวิธีนี้ในช่วงกลางศตวรรษที่ผ่านมาในสหรัฐอเมริกา
ราคาแคลเซียม
มีผู้ผลิตโลหะแคลเซียมเพียงไม่กี่ราย ดังนั้นในรัสเซีย อุปทานส่วนใหญ่ดำเนินการโดยโรงงานเครื่องจักรกล Chapetsk ตั้งอยู่ในอัดมูร์เทีย บริษัทจำหน่ายเม็ด ขี้กบ และโลหะก้อน ป้ายราคาต่อตันวัตถุดิบอยู่ที่ประมาณ 1,500 เหรียญสหรัฐ
ผลิตภัณฑ์นี้มีจำหน่ายในห้องปฏิบัติการเคมีบางแห่ง เช่น สมาคมนักเคมีแห่งรัสเซีย ล่าสุดเสนอ 100 กรัม แคลเซียม. รีวิวระบุว่าเป็นแป้งอยู่ใต้น้ำมัน ราคาหนึ่งแพ็คเกจคือ 320 รูเบิล
นอกจากข้อเสนอซื้อแคลเซียมแท้แล้ว แผนธุรกิจสำหรับการผลิตยังจำหน่ายบนอินเทอร์เน็ตอีกด้วย สำหรับการคำนวณทางทฤษฎีประมาณ 70 หน้าพวกเขาขอเงินประมาณ 200 รูเบิล แผนส่วนใหญ่จัดทำขึ้นในปี 2558 นั่นคือยังไม่สูญเสียความเกี่ยวข้อง
อ่านยัง...
- เวอร์ชัน: พื้นฐานของคำสอนที่แท้จริงของพระคริสต์คือประเพณีเวท
- ความเชื่อโบราณของชาวสลาฟ ความเชื่อของชาวสลาฟก่อนคริสต์ศาสนา
- "เครื่องบินใต้สะพาน": วันครบรอบการทำลายล้างการบินของไซบีเรีย
- ความโหดร้ายของลัทธิฟาสซิสต์: การฆาตกรรมเด็ก นักฆ่าเด็กฟาสซิสต์ - ประวัติศาสตร์ในภาพถ่าย - LiveJournal รัสเซียฆ่าเด็กของฟาสซิสต์