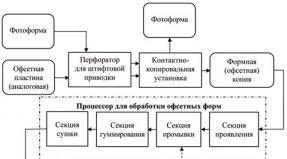
การละเมิดปริมาณโปรตีนที่สังเคราะห์ได้ การรบกวนในการสร้างและการขับถ่ายของผลิตภัณฑ์ขั้นสุดท้ายของการเผาผลาญโปรตีน ความไม่สมดุลของไนโตรเจน
สาเหตุที่ทำให้เกิดการรบกวนในการสังเคราะห์โปรตีนสถานที่สำคัญถูกครอบครองโดยการขาดสารอาหารประเภทต่างๆ (การอดอาหารที่สมบูรณ์, ไม่สมบูรณ์, การขาดกรดอะมิโนที่จำเป็นในอาหาร, การละเมิดอัตราส่วนเชิงปริมาณบางอย่างระหว่างกรดอะมิโนที่จำเป็นที่เข้าสู่ร่างกาย)
ตัวอย่างเช่น หากทริปโตเฟน ไลซีน และวาลีนมีอยู่ในโปรตีนของเนื้อเยื่อในอัตราส่วนที่เท่ากัน (1:1:1) และกรดอะมิโนเหล่านี้ได้รับมาพร้อมกับโปรตีนในอาหารในอัตราส่วน 1:1:0.5 ดังนั้น การสังเคราะห์โปรตีนของเนื้อเยื่อ จะมั่นใจได้เท่าๆ กันครึ่งหนึ่ง การไม่มีกรดอะมิโนจำเป็นอย่างน้อยหนึ่งตัว (จาก 20) ในเซลล์จะหยุดการสังเคราะห์โปรตีนโดยรวม
การด้อยค่าของอัตราการสังเคราะห์โปรตีนอาจเกิดจากความผิดปกติในการทำงานของโครงสร้างทางพันธุกรรมที่เกี่ยวข้อง ความเสียหายต่ออุปกรณ์ทางพันธุกรรมอาจเป็นได้ทั้งทางพันธุกรรมหรือได้มาซึ่งเกิดขึ้นภายใต้อิทธิพลของปัจจัยก่อกลายพันธุ์ต่างๆ (รังสีไอออไนซ์, รังสีอัลตราไวโอเลต ฯลฯ ) ยาปฏิชีวนะบางชนิดทำให้เกิดการหยุดชะงักของการสังเคราะห์โปรตีน ดังนั้น "ข้อผิดพลาด" ในการอ่านรหัสพันธุกรรมจึงอาจเกิดขึ้นได้ภายใต้อิทธิพลของสเตรปโตมัยซิน นีโอมัยซิน และยาปฏิชีวนะอื่น ๆ Tetracyclines ยับยั้งการเติมกรดอะมิโนใหม่ลงในสายโซ่โพลีเปปไทด์ที่กำลังเติบโต (การก่อตัวของพันธะโควาเลนต์ที่แข็งแกร่งระหว่างสายโซ่) ป้องกันการแตกตัวของสาย DNA
สาเหตุสำคัญประการหนึ่งที่ทำให้เกิดการหยุดชะงักของการสังเคราะห์โปรตีนอาจเป็นเพราะกระบวนการนี้ผิดปกติ การควบคุมความเข้มข้นและทิศทางของการเผาผลาญโปรตีนนั้นถูกควบคุมโดยระบบประสาทและต่อมไร้ท่อ ซึ่งผลกระทบดังกล่าวจะเกิดขึ้นได้จากการมีอิทธิพลต่อระบบเอนไซม์ต่างๆ การละเลยของสัตว์ทำให้สัตว์ลดลง
การสังเคราะห์โปรตีน ฮอร์โมนการเจริญเติบโต ฮอร์โมนเพศ และอินซูลินภายใต้สภาวะบางประการจะกระตุ้นการสังเคราะห์โปรตีน ในที่สุดสาเหตุของพยาธิสภาพอาจเป็นการเปลี่ยนแปลงในกิจกรรมของระบบเอนไซม์ของเซลล์ที่เกี่ยวข้องกับการสังเคราะห์โปรตีน
ผลลัพธ์ของปัจจัยเหล่านี้คืออัตราการสังเคราะห์โปรตีนแต่ละชนิดลดลง
การเปลี่ยนแปลงเชิงปริมาณในการสังเคราะห์โปรตีนสามารถนำไปสู่การเปลี่ยนแปลงอัตราส่วนของเศษส่วนโปรตีนแต่ละตัวในซีรั่มในเลือด - ภาวะ dysproteinemia ภาวะ dysproteinemia มีสองรูปแบบ: ภาวะโปรตีนในเลือดสูง (ปริมาณโปรตีนทั้งหมดหรือแต่ละประเภทเพิ่มขึ้น) และภาวะโปรตีนในเลือดต่ำ (ปริมาณโปรตีนทั้งหมดหรือโปรตีนส่วนบุคคลลดลง) ดังนั้นโรคตับบางชนิด (โรคตับแข็ง, ตับอักเสบ), ไต (โรคไตอักเสบ, โรคไต) จึงมาพร้อมกับการสังเคราะห์อัลบูมินที่ลดลงและเนื้อหาในซีรั่มลดลง โรคติดเชื้อจำนวนหนึ่งที่มาพร้อมกับกระบวนการอักเสบที่กว้างขวางนำไปสู่การสังเคราะห์เพิ่มขึ้นและการเพิ่มขึ้นของแกมมาโกลบูลินในซีรั่มในเวลาต่อมา การพัฒนาของภาวะ dysproteinemia มักจะมาพร้อมกับการเปลี่ยนแปลงของสภาวะสมดุล (ความดัน oncotic ที่บกพร่อง, ความสมดุลของน้ำ) การสังเคราะห์โปรตีนลดลงอย่างมีนัยสำคัญ โดยเฉพาะอัลบูมินและแกมมาโกลบูลิน ส่งผลให้ความต้านทานต่อการติดเชื้อของร่างกายลดลงอย่างรวดเร็ว
ด้วยความเสียหายต่อตับและไตกระบวนการอักเสบเฉียบพลันและเรื้อรังบางอย่าง (โรคไขข้ออักเสบกล้ามเนื้อหัวใจอักเสบติดเชื้อปอดบวม) การเปลี่ยนแปลงเชิงคุณภาพเกิดขึ้นในการสังเคราะห์โปรตีนและสังเคราะห์โปรตีนพิเศษที่มีคุณสมบัติที่เปลี่ยนแปลงเช่นโปรตีน C-reactive ตัวอย่างของโรคที่เกิดจากการปรากฏตัวของโปรตีนทางพยาธิวิทยาคือโรคที่เกี่ยวข้องกับการปรากฏตัวของฮีโมโกลบินทางพยาธิวิทยา (ฮีโมโกลบิน) ความผิดปกติของการแข็งตัวของเลือดที่มีลักษณะของไฟบริโนเจนทางพยาธิวิทยา โปรตีนในเลือดที่ผิดปกติ ได้แก่ cryoglobulins ซึ่งสามารถตกตะกอนได้ที่อุณหภูมิต่ำกว่า 37 ° C (โรคทางระบบ, โรคตับแข็งของตับ)
พรีเฟรันสกายา นีน่า เจอร์มานอฟนา
รองศาสตราจารย์ภาควิชาเภสัชวิทยา คณะเภสัชศาสตร์ มหาวิทยาลัยการแพทย์แห่งรัฐมอสโกแห่งแรกที่ได้รับการตั้งชื่อตาม พวกเขา. เซเชนอฟ
ยาปฏิชีวนะมีฤทธิ์ฆ่าเชื้อแบคทีเรียเป็นส่วนใหญ่ ยกเว้นอะมิโนไกลโคไซด์ที่มีฤทธิ์ฆ่าเชื้อแบคทีเรียและยาที่ใช้ในปริมาณมาก ยาเหล่านี้มีฤทธิ์ต้านจุลชีพในวงกว้างและมักใช้ในการปฏิบัติทางคลินิกโดยเฉพาะอย่างยิ่งในการรักษาการติดเชื้อที่หายากเช่น bartonellosis, brucellosis, cryptosporidiosis, cystic fibrosis, toxoplasmosis, tularemia, วัณโรค โรคแอนแทรกซ์, อหิวาตกโรค, โรคระบาด ฯลฯ
ส่วนที่ 1 Macrolides
Macrolides เป็นยาปฏิชีวนะประเภทหนึ่งที่บรรจุวงแหวนแลคโตน Macrocyclic ในโมเลกุลที่เกี่ยวข้องกับคาร์โบไฮเดรตตกค้างของน้ำตาลอะมิโน ขึ้นอยู่กับจำนวนอะตอมของคาร์บอนที่ประกอบเป็นวงแหวนนั้น macrolides ที่มีสมาชิก 14 สมาชิก, 15 สมาชิกและ 16 สมาชิกมีความโดดเด่น ในบรรดายาปฏิชีวนะที่มีอยู่ทั้งหมด Macrolides ได้พิสูจน์ตัวเองแล้วว่ามีประสิทธิภาพและปลอดภัยที่สุดในการใช้ยาเคมีบำบัด Macrolides แบ่งออกเป็นสองกลุ่ม: ธรรมชาติและกึ่งสังเคราะห์ .
ฤทธิ์ต้านจุลชีพของ Macrolides เกิดจากการหยุดชะงักของการสังเคราะห์โปรตีนบนไรโบโซมของเซลล์จุลินทรีย์ Macrolides จะจับกับโดเมนต่างๆ ของ catalytic peptyl transferase center ของหน่วยย่อยไรโบโซม 50S และยับยั้งกระบวนการโยกย้ายและการเปลี่ยนเปปไทด์ของเปปไทด์ ซึ่งนำไปสู่การหยุดการชุมนุมของโมเลกุลโปรตีน และทำให้ความสามารถของจุลินทรีย์ในการแบ่งและสืบพันธุ์ช้าลง ขึ้นอยู่กับชนิดของจุลินทรีย์และความเข้มข้นของยาพวกมันมีผลขึ้นอยู่กับขนาดยาแสดงผลของแบคทีเรียและในปริมาณมากและในจุลินทรีย์บางสายพันธุ์ - มีฤทธิ์ฆ่าเชื้อแบคทีเรีย สเปกตรัมของการออกฤทธิ์ต้านจุลชีพนั้นใกล้เคียงกับกลุ่มเพนิซิลลินตามธรรมชาติมาก
Macrolides มีคุณสมบัติ lipophilic ดูดซึมเข้าสู่ทางเดินอาหารได้อย่างรวดเร็ว สร้างเนื้อเยื่อและความเข้มข้นในเซลล์สูง กระจายอยู่ในเนื้อเยื่อและสารคัดหลั่งจำนวนมาก ถูกกักเก็บไว้ในของเหลวนอกเซลล์ได้ไม่ดี และไม่ทะลุ BBB ผลของมันปรากฏชัดในระยะการสืบพันธุ์เป็นหลัก พวกมันมีประสิทธิภาพสูงต่อการแบ่งตัวของจุลินทรีย์เท่านั้นดังนั้นจึงได้พิสูจน์ตัวเองในการรักษาระยะเฉียบพลันของโรคและมีผลเพียงเล็กน้อยหรือไม่มีเลยต่อกระบวนการที่ซบเซา
พวกเขาเพิ่มกิจกรรมต่อต้านกรัม "+" cocci และเชื้อโรคในเซลล์ (chlamydia, mycoplasmas, Legionella), ยับยั้งการพัฒนาของ cocci แกรมลบ, คอตีบ bacilli, เชื้อโรคของโรคแท้งติดต่อ, โรคบิดอะมีบา เกี่ยวกับจุลินทรีย์แกรม “-” ของตระกูล Enterobacteriaceae P. aeruginosa และกรัม “-” แอนแอโรบิกมีความทนทาน Pseudomonas และ Acinetobacter มีความทนทานต่อ Macrolides ทั้งหมดตามธรรมชาติ ความต้านทานของจุลินทรีย์ต่อยากลุ่มนี้สัมพันธ์กับการเปลี่ยนแปลงโครงสร้างของตัวรับในหน่วยย่อย 50S ของไรโบโซมซึ่งนำไปสู่การหยุดชะงักของการจับกันของยาปฏิชีวนะกับไรโบโซม ในแมโครไลด์ ลินโคซาไมด์ และเฟนิคอล การจับกับหน่วยย่อยไรโบโซม 50S เกิดขึ้นที่ตำแหน่งต่างๆ ซึ่งส่งผลให้ไม่มีการต้านทานข้าม คุณสมบัติของฤทธิ์ต้านจุลชีพของ Macrolides คือฤทธิ์ต้านเชื้อแบคทีเรียต่อแบคทีเรียในรูปแบบเหล่านั้นที่ต้านทานต่อกลุ่มที่ใช้กันอย่างแพร่หลายเช่นเพนิซิลลินสเตรปโตมัยซินและเตตราไซคลีน
Macrolides ใช้สำหรับการติดเชื้อทางเดินหายใจส่วนล่าง รวมถึงรูปแบบที่ผิดปกติ การกำเริบของโรคหลอดลมอักเสบเรื้อรัง และโรคปอดบวมจากชุมชน กำหนดไว้สำหรับการติดเชื้อทางเดินหายใจส่วนบน (ไซนัสอักเสบ, โรคหูน้ำหนวก, หลอดลมอักเสบ, ต่อมทอนซิลอักเสบ), การติดเชื้อในช่องปาก, เนื้อเยื่ออ่อน, ผิวหนัง, สิวที่ติดเชื้อและการติดเชื้อทางเดินปัสสาวะ ข้อบ่งชี้ในการใช้งานคือการป้องกันและรักษาโรคมัยโคแบคทีเรีย การป้องกันโรคไข้รูมาติก เยื่อบุหัวใจอักเสบ โดยมีวัตถุประสงค์เพื่อกำจัดเชื้อ H. ไพโลไร ( คลาริโธรมัยซิน- คุณสมบัติทางภูมิคุ้มกันของ Macrolides ใช้สำหรับโรค panbronchonchiolitis ( คลาริโธรมัยซิน, ร็อกซิโทรมัยซิน) และซิสติกไฟโบรซิส ( อะซิโทรมัยซิน).
ขั้นพื้นฐาน ผลข้างเคียงเมื่อใช้ Macrolides - ความผิดปกติของระบบทางเดินอาหารซึ่งมีความเสี่ยงไม่เกิน 5-8% ในบางกรณีที่พบไม่บ่อย ปฏิกิริยาภูมิแพ้จะเกิดขึ้น 2-3% (ผื่นที่ผิวหนัง อาการบวมที่ใบหน้า คอ เท้า อาการช็อก) โรคตับอักเสบ cholestatic และลำไส้ใหญ่ปลอม ความถี่ที่เล็กที่สุดในการบริหารยา Macrolides พารามิเตอร์ทางเภสัชจลนศาสตร์ที่ได้รับการปรับปรุงไม่จำเป็นต้องปรับขนาดยาในกรณีไตวายและผู้ป่วยสามารถทนได้ดี Macrolides ส่วนใหญ่ (โดยเฉพาะ erythromycin และ clarithromycin) เป็นตัวยับยั้งที่มีศักยภาพของ cytochrome P-450 (CYP 3A 4, CYP3A5, CYP3A7, CYP 1A 2) ดังนั้นการใช้งานของพวกเขาจึงขัดขวางการเปลี่ยนรูปทางชีวภาพและเพิ่มความเข้มข้นสูงสุดในเลือดของยาที่บริหารร่วม นี่เป็นสิ่งสำคัญอย่างยิ่งที่ต้องพิจารณาเมื่อใช้ วาร์ฟาริน, ไซโคลสปอริน, ธีโอฟิลลีน, ดิจอกซิน, คาร์บามาซีพีนฯลฯ ซึ่งถูกเผาผลาญในตับ การใช้งานร่วมกันอาจทำให้เกิดภาวะแทรกซ้อนที่อันตรายที่สุด (การรบกวนจังหวะการเต้นของหัวใจ, การยืดช่วง Q-T, การพัฒนาของแขนขาขาดเลือดและเนื้อตายเน่า) Spiramycin และ azithromycin ไม่เกิดปฏิกิริยาออกซิเดชันโดย cytochrome P-450 ในร่างกาย Macrolides ได้รับการหมุนเวียนในลำไส้เล็กส่วนใหญ่จะถูกขับออกทางน้ำดีและมีเพียง 5-10% ของยาเท่านั้นที่ถูกขับออกทางไต
อิริโทรมัยซิน (อิริโทรไมนัม)ผลิตโดย actinomycetes ในดิน (เชื้อราที่เปล่งประกาย) จากของเหลวทางวัฒนธรรมที่แยกได้ในปี 1952 มันถูกดูดซึมได้ดีจากทางเดินอาหาร ในสภาพแวดล้อมที่เป็นกรดของกระเพาะอาหารจะถูกทำลายบางส่วนดังนั้นจึงควรให้ erythromycin ในแท็บเล็ตที่เคลือบด้วยสารเคลือบทนกรดซึ่งจะละลายในลำไส้เท่านั้น ยาเสพติดแทรกซึมเข้าไปในเนื้อเยื่อต่าง ๆ ได้อย่างง่ายดายรวมถึง ข้ามสิ่งกีดขวางรก ในเนื้อเยื่อสมอง สภาวะปกติไม่มาถึง หลังจากรับประทานยาเพียงครั้งเดียว ความเข้มข้นสูงสุดในเลือดจะถึงหลังจากผ่านไป 2 ชั่วโมง Erythromycin มีการดูดซึมได้ 2-3 ชั่วโมง ดังนั้นเพื่อรักษาระดับการรักษาในเลือดจึงควรให้ยา 4 ครั้งต่อวัน ปริมาณที่สูงขึ้นทางปาก: เดี่ยว - 0.5 กรัม, ทุกวัน - 2 กรัม, ขับออกทางอุจจาระและบางส่วนในปัสสาวะ เม็ด Erythromycin ใช้กันอย่างแพร่หลายในการรักษาโรคปอดบวม, หลอดลมอักเสบจากสาเหตุต่างๆ, ไข้อีดำอีแดง, ต่อมทอนซิลอักเสบ, หูชั้นกลางอักเสบเป็นหนอง, คอตีบและการติดเชื้อที่บาดแผล ยานี้ใช้สำหรับโรคติดเชื้อร้ายแรงในการรักษาโรคไอกรนคอตีบ สำหรับโรคตาแดงในทารกแรกเกิดให้ฉีดเข้าเส้นเลือดดำโดยเจือจางครั้งเดียวในสารละลายโซเดียมคลอไรด์ไอโซโทนิก 250 มล. ฉีดช้าๆในหนึ่งชั่วโมง ใน gastroparesis นั้น erythromycin ขึ้นอยู่กับขนาดยาจะกระตุ้นการเคลื่อนไหวของกระเพาะอาหาร เพิ่มความกว้างของการหดตัวของ pyloric และปรับปรุงการประสานงานระหว่าง antral และ duodenal ใช้เฉพาะในรูปแบบของครีมและสารละลายสำหรับใช้ภายนอกในการรักษาโรคผิวหนังอักเสบเป็นหนอง, บาดแผลที่ติดเชื้อ, แผลในกระเพาะอาหาร, แผลกดทับและแผลไหม้ในระดับ II-III ความต้านทานของจุลินทรีย์ต่อ erythromycin พัฒนาอย่างรวดเร็ว ยานี้มีความเป็นพิษต่ำและไม่ค่อยทำให้เกิดผลข้างเคียง บางครั้งอาการป่วยไม่สบาย (คลื่นไส้, อาเจียน) และเกิดอาการแพ้ การดูดซึมจะลดลงอย่างมีนัยสำคัญเมื่อรับประทานอีรีโทรมัยซินพร้อมหรือหลังอาหารเพราะว่า อาหารช่วยลดความเข้มข้นของยาปฏิชีวนะในเลือดได้มากกว่า 2 เท่า มีจำหน่ายทั้งแบบท่อและแบบเคลือบ โอบอล 100 และ 250 มก.; ครีมบำรุงรอบดวงตา 10 กรัม (ใน 1 กรัม 10,000 หน่วย) ครีมสำหรับใช้ภายนอกและในท้องถิ่น 15 มก. - 10,000 หน่วย / กรัม เหน็บสำหรับเด็ก 0.05 กรัมและ 0.1 กรัม ผงสำหรับฉีด 0.05, 0.1 และ 0.2 กรัม และเม็ดสำหรับแขวนลอย 0.125 กรัม และ 0.2 กรัม ในขวดขนาด 5 มล.
นอกจากนี้ยังมี ผลกระทบที่เป็นพิษเกี่ยวข้องกับผลโดยตรงของซีโนไบโอติกต่อไมโครโซมอลโมโนออกซีจีเนส โดยทั่วไปนี่คือกลไกของผลกระทบที่เป็นพิษของคาร์บอนเตตราคลอไรด์ ซึ่งจะละลายในองค์ประกอบเมมเบรนทั้งหมดของเซลล์ตับโดยมีการสะสมส่วนใหญ่ในส่วนของไมโครโซม ที่นี่จับกับไซโตโครม P-450 และปฏิกิริยาการรีดักชันที่เกิดขึ้นอย่างรวดเร็วนำไปสู่การก่อตัวของอนุมูล CCl3 ซึ่งเป็นตัวกระตุ้นในกลไกของผลเสียหายของซีโนไบโอติกนี้
อนุมูลกระตุ้นอย่างรุนแรง การเกิดออกซิเดชันของไขมันทำให้เกิดความเสียหายต่อไบโอเมมเบรนและนำไปสู่การทำลายไซโตโครม P-450 เป็นผลให้กลไกเหล่านี้ประกอบกับกลไกอื่นที่มีนัยสำคัญน้อยกว่าทำให้เซลล์ตาย สำหรับกลไกความเป็นพิษที่อธิบายไว้สั้น ๆ ที่นี่ A.I. Archakov ได้แนะนำคำว่า "การสลายตัวถึงตาย"
เมื่อมีปฏิสัมพันธ์กัน ซีโนไบโอติกด้วย microsomal monooxygenases ไม่สามารถสร้างอนุมูลได้ แต่เป็นผลิตภัณฑ์ที่เสถียรและมีพิษสูงซึ่งนำไปสู่อาการมึนเมา พิษเวอร์ชันนี้เรียกว่า "การสังเคราะห์ที่ทำให้ถึงตาย" ตัวอย่างเช่น การก่อตัวของกรดฟลูออโรซิตริกที่เป็นพิษจากฟลูออโรอะซิเตต การสะสมของฟอร์มาลดีไฮด์และกรดฟอร์มิกในระหว่างการเปลี่ยนแปลงออกซิเดชันของเมทานอล เป็นต้น
ทั้งหมด สารเคมี, การสังเคราะห์โปรตีนที่สร้างความเสียหายสามารถแบ่งออกได้เป็น 2 กลุ่ม ประการแรกประกอบด้วยซีโนไบโอติกที่มีผลทางอ้อมต่อการสังเคราะห์โปรตีนผ่านการเปลี่ยนแปลงกระบวนการพลังงานชีวภาพ สถานะของฮอร์โมน การซึมผ่านของไบโอเมมเบรน ฯลฯ การละเมิดการสังเคราะห์โปรตีนในกลไกของการกระทำที่เป็นพิษเป็นปรากฏการณ์รองที่ซับซ้อน แต่ไม่ได้กำหนดการพัฒนาของความมึนเมา ตัวอย่างจะเป็นคลอรีนไฮโดรคาร์บอน ดังนั้นเตตราคลอโรอัลเคนจึงยับยั้งการรวมตัวของเมไทโอนีนและไลซีนเข้ากับโปรตีนในซีรั่มและตับ
ยังมีอีกกลไกหนึ่ง: ในกระบวนการเมแทบอลิซึมของซีโนไบโอติกส์จะเกิดอนุมูลอิสระและเปอร์ออกไซด์ซึ่งส่งผลต่อฟอสโฟไลปิดของเยื่อหุ้มของเอนโดพลาสซึมเรติคูลัมและทำลายพวกมันซึ่งก่อให้เกิดการหยุดชะงักของการสังเคราะห์โปรตีน โดยเฉพาะอย่างยิ่งการสูดดมไดคลอโรอีเทนจะนำไปสู่การยับยั้งการรวมตัวของลิวซีนในโปรตีนตับของหนูและทำให้เกิดความเสียหายต่อโครงสร้างโพลีไรโบโซมของเซลล์ตับ ในซิลิโคซิส การสังเคราะห์โปรตีนมาโครฟาจจะถูกยับยั้งในปอด ในโรคเบริลลิโอซิสเรื้อรังกระบวนการรวมตัวของกรดอะมิโนเข้ากับโปรตีนปอดจะหยุดชะงัก ภายใต้อิทธิพลของตะกั่ว การใช้เมไทโอนีนในการสังเคราะห์โปรตีนจะถูกยับยั้ง กระบวนการนี้ยังถูกระงับโดยสารประกอบออร์กาโนเมอร์คิวรี
กลุ่มที่สอง ซีโนไบโอติกรวมถึงสารประกอบที่ยับยั้งการสังเคราะห์โปรตีนโดยตรงโดยการแทรกแซงกระบวนการถอดรหัสหรือการแปล ส่วนสำคัญของซีโนไบโอติกส์ขัดขวางกระบวนการถอดรหัส ทำลายเมทริกซ์ เช่น ดีเอ็นเอ. ภายใต้อิทธิพลของพวกมัน พันธะโควาเลนต์ระหว่างนิวคลีโอไทด์จะถูกรบกวนและกลุ่มการทำงานของพวกมันได้รับการแก้ไขเนื่องจากการก่อตัวของสารเชิงซ้อน การสูญเสียหรือการทำลายส่วนของสายโซ่ DNA นี่เป็นวิธีการทำงานของสารประกอบอัลคิเลตอย่างแท้จริง ยาปฏิชีวนะกลุ่มใหญ่ขัดขวาง DNA คุณสมบัติเทมเพลตของ DNA ได้รับความเสียหายจากซีโนไบโอติกจำนวนมากของซีรีส์อะคริดีน ซึ่งแทรกอยู่ระหว่างเบสของกรดนิวคลีอิก
ส่งผลให้ การสังเคราะห์ mRNA ลดลง(เมทริกซ์ไรโบนิวคลีอิกแอซิด) และการสังเคราะห์โปรตีนจะถูกยับยั้ง อะมานิตินผลิตภัณฑ์ เห็ดพิษสกุล Amanita ขัดขวางการถอดรหัสโดยการยับยั้งการทำงานของ RNA polymerase ซึ่งนำไปสู่การยับยั้งการสังเคราะห์โปรตีนด้วย
ซีโนไบโอติกส์ซึ่งขัดขวางการแปล สามารถแบ่งออกเป็นกลุ่มขึ้นอยู่กับขั้นตอนของการแปลที่พวกเขาดำเนินการ ตัวอย่างเช่นในขั้นตอนของการเริ่มต้นกระบวนการแปล dihydroxybutyraldehyde และ methylglyoxal, แอนไอออนสังเคราะห์ - โพลีไวนิลซัลเฟต, โพลีเดกซ์แทรนซัลเฟต ฯลฯ และสารพิษจากเชื้อราไตรโคเธซีนออกฤทธิ์ อย่างไรก็ตามกลไกการออกฤทธิ์อาจแตกต่างกัน: อะลิฟาติกอัลดีไฮด์ขัดขวางการแนบ mRNA กับไรโบโซม; โพลีไวนิลซัลเฟตจับกับไรโบโซมที่บริเวณที่ mRNA ยึดติด polyanion อื่นๆ จะขัดขวางอันตรกิริยาของหน่วยย่อยของไรโบโซม ซีโนไบโอติกส์ที่รบกวนการแปลในระยะการยืดตัวอาจมีกลไกการออกฤทธิ์ที่แตกต่างกัน ตัวอย่างเช่น การก่อตัวของพันธะเปปไทด์ในระยะการยืดตัวจะถูกบล็อกโดยอีริโธรมัยซินและโอเลแอนโดมัยซิน สารพิษจากโรคคอตีบขัดขวางการโยกย้าย ไซโคลเฮกซิไมด์และอนุพันธ์ของมันขัดขวางการโยกย้ายในลักษณะที่แตกต่างออกไปเล็กน้อย ในขั้นตอนของการยุติกระบวนการแปลกรดเทนัวโซนิกจะทำหน้าที่ยับยั้งการแยกโปรตีนที่เกิดขึ้นใหม่จากไรโบโซม
เมื่อพิจารณาเสร็จแล้ว ความผิดปกติของการสังเคราะห์โปรตีนซีโนไบโอติกจะบ่งบอกถึงความเป็นไปได้ในการยับยั้งกระบวนการกระตุ้นการทำงานของกรดอะมิโนและยับยั้งการทำงานของอะมิโนเอซิล-tRNA synthetases สารที่ออกฤทธิ์ในลักษณะนี้ส่วนใหญ่รวมถึงสารอะนาล็อกสังเคราะห์ของกรดอะมิโนธรรมชาติ เช่น 5-เมทิลทริปโตเฟน, 2-เมทิลฮิสทิดีน, เมทิลโฮโมซิสเทอีน, ซิสฟลูออโรโพรลีน, ฟลูออโรฟีนิลอะลานีน, เอไทโอนีน, คานาวานีน เป็นต้น สารซีโนไบโอติกเหล่านี้ยับยั้งการรวมตัวของกรดอะมิโนธรรมชาติเข้าไปในโปรตีนเนื่องจาก การยับยั้งการแข่งขันที่สอดคล้องกับการสังเคราะห์อะมิโนเอซิล
กลไกทางชีววิทยาทั่วไป การดำเนินการตามผลกระทบที่เป็นพิษยังเป็นความผิดปกติของกระบวนการพลังงานชีวภาพ ซึ่งมักเกี่ยวข้องกับความซับซ้อนของโครงสร้างและเมตาบอลิซึมของไมโตคอนเดรีย
ความผิดปกติของระบบเมตาบอลิซึมเป็นสาเหตุให้เกิดความเสียหายต่ออวัยวะและเนื้อเยื่อจากการทำงานและอินทรีย์ที่นำไปสู่การเกิดโรค ในเวลาเดียวกันพยาธิวิทยาทางเมตาบอลิซึมอาจทำให้โรคประจำตัวรุนแรงขึ้นโดยทำหน้าที่เป็นปัจจัยแทรกซ้อน
หนึ่งในสาเหตุที่พบบ่อยที่สุด การละเมิดทั่วไปเมแทบอลิซึมของโปรตีนคือการขาดโปรตีนเชิงปริมาณหรือเชิงคุณภาพจากแหล่งกำเนิดหลัก (ภายนอก) อาจเป็นเพราะ:
1. การละเมิดการสลายและการดูดซึมโปรตีนในระบบทางเดินอาหาร
2. ชะลอการไหลของกรดอะมิโนเข้าสู่อวัยวะและเนื้อเยื่อ
3. การละเมิดการสังเคราะห์โปรตีน
4. การละเมิดการเผาผลาญกรดอะมิโนคั่นระหว่างหน้า;
5. การเปลี่ยนแปลงอัตราการสลายโปรตีน
6. พยาธิวิทยาของการก่อตัวของผลิตภัณฑ์ขั้นสุดท้ายของการเผาผลาญโปรตีน
ความผิดปกติของการสลายและการดูดซึมโปรตีน- ในระบบทางเดินอาหาร โปรตีนจะถูกสลายภายใต้อิทธิพลของเอนไซม์โปรตีโอไลติก ในเวลาเดียวกันสารโปรตีนและสารประกอบไนโตรเจนอื่น ๆ จะสูญเสียคุณสมบัติเฉพาะไป
สาเหตุหลักของการสลายโปรตีนไม่เพียงพอคือการลดลงเชิงปริมาณในการหลั่งกรดไฮโดรคลอริกและเอนไซม์, กิจกรรมของเอนไซม์โปรตีโอไลติกลดลง (เปปซิน, ทริปซิน, ไคโมทริปซิน) และการก่อตัวของกรดอะมิโนไม่เพียงพอที่เกี่ยวข้อง การกระทำของพวกเขา (การเร่งความเร็วของการบีบตัว)
นอกจาก อาการทั่วไปความผิดปกติของการเผาผลาญกรดอะมิโนอาจเป็นความผิดปกติเฉพาะที่เกี่ยวข้องกับการขาดกรดอะมิโนจำเพาะ ดังนั้นการขาดไลซีน (โดยเฉพาะในสิ่งมีชีวิตที่กำลังพัฒนา) จะชะลอการเจริญเติบโตและการพัฒนาโดยทั่วไป ทำให้ปริมาณฮีโมโกลบินและเซลล์เม็ดเลือดแดงในเลือดลดลง เมื่อร่างกายขาดทริปโตเฟนจะเกิดภาวะโลหิตจางจากภาวะ hypochromic การขาดอาร์จินีนนำไปสู่การสร้างสเปิร์มที่บกพร่อง และการขาดฮิสทิดีนทำให้เกิดกลาก การชะลอการเจริญเติบโต และการยับยั้งการสังเคราะห์ฮีโมโกลบิน
นอกจากนี้การย่อยโปรตีนไม่เพียงพอในระบบทางเดินอาหารส่วนบนจะมาพร้อมกับการถ่ายโอนผลิตภัณฑ์จากการสลายที่ไม่สมบูรณ์ไปยังลำไส้ใหญ่เพิ่มขึ้นและกระบวนการสลายกรดอะมิโนของแบคทีเรียเพิ่มขึ้น สิ่งนี้นำไปสู่การเพิ่มขึ้นของการก่อตัวของสารประกอบอะโรมาติกที่เป็นพิษ (อินโดล, สกาโทล, ฟีนอล, ครีโซล) และการพัฒนาความเป็นพิษโดยทั่วไปของร่างกายด้วยผลิตภัณฑ์ที่สลายตัวเหล่านี้
การชะลอการจัดหากรดอะมิโนเข้าสู่อวัยวะและเนื้อเยื่อ เนื่องจากกรดอะมิโนจำนวนหนึ่งเป็นสารตั้งต้นสำหรับการก่อตัวของเอมีนทางชีวภาพ การกักเก็บกรดอะมิโนเหล่านี้ในเลือดจึงสร้างเงื่อนไขสำหรับการสะสมของเอมีนโปรตีนที่สอดคล้องกันในเนื้อเยื่อและเลือด และการปรากฏตัวของผลกระทบที่ทำให้เกิดโรคในอวัยวะและระบบต่างๆ ระดับไทโรซีนในเลือดที่เพิ่มขึ้นส่งเสริมการสะสมของไทรามีนซึ่งเกี่ยวข้องกับการเกิดโรคความดันโลหิตสูงที่เป็นมะเร็ง ปริมาณฮิสติดีนที่เพิ่มขึ้นเป็นเวลานานทำให้ความเข้มข้นของฮิสตามีนเพิ่มขึ้นซึ่งส่งผลให้การไหลเวียนโลหิตบกพร่องและการซึมผ่านของเส้นเลือดฝอย นอกจากนี้การเพิ่มขึ้นของปริมาณกรดอะมิโนในเลือดนั้นเกิดจากการขับถ่ายปัสสาวะเพิ่มขึ้นและการก่อตัวของความผิดปกติของการเผาผลาญรูปแบบพิเศษ - อะมิโนอะซิดูเรีย กรดอะมิโนอาจเป็นเรื่องทั่วไปซึ่งสัมพันธ์กับการเพิ่มความเข้มข้นของกรดอะมิโนหลายชนิดในเลือดหรือแบบเลือก - โดยเพิ่มเนื้อหาของกรดอะมิโนตัวใดตัวหนึ่งในเลือด
ความผิดปกติในการสังเคราะห์โปรตีน- การสังเคราะห์โครงสร้างโปรตีนในร่างกายเป็นจุดเชื่อมโยงหลักในการเผาผลาญโปรตีน แม้แต่การรบกวนเล็กน้อยในความจำเพาะของการสังเคราะห์โปรตีนก็สามารถนำไปสู่การเปลี่ยนแปลงทางพยาธิวิทยาอย่างลึกซึ้งในร่างกายได้
การไม่มีกรดอะมิโนจำเป็นอย่างน้อยหนึ่งตัว (จาก 20) ในเซลล์จะหยุดการสังเคราะห์โปรตีนโดยรวม
การด้อยค่าของอัตราการสังเคราะห์โปรตีนอาจเกิดจากความผิดปกติในการทำงานของโครงสร้างทางพันธุกรรมที่เกี่ยวข้องซึ่งเกิดการสังเคราะห์นี้ (การถอดรหัส DNA, การแปล)
ความเสียหายต่ออุปกรณ์ทางพันธุกรรมอาจเป็นได้ทั้งทางพันธุกรรมหรือได้มาซึ่งเกิดขึ้นภายใต้อิทธิพลของปัจจัยก่อกลายพันธุ์ต่างๆ (รังสีไอออไนซ์, รังสีอัลตราไวโอเลต ฯลฯ ) ยาปฏิชีวนะบางชนิดสามารถขัดขวางการสังเคราะห์โปรตีนได้ ดังนั้น "ข้อผิดพลาด" ในการอ่านรหัสพันธุกรรมจึงอาจเกิดขึ้นได้ภายใต้อิทธิพลของสเตรปโตมัยซิน นีโอมัยซิน และยาปฏิชีวนะอื่น ๆ อีกหลายชนิด Tetracyclines ยับยั้งการเติมกรดอะมิโนใหม่ลงในสายพอลิเปปไทด์ที่กำลังเติบโต Mitomycin ยับยั้งการสังเคราะห์โปรตีนเนื่องจาก DNA alkylation (การก่อตัวของพันธะโควาเลนต์ที่แข็งแกร่งระหว่างสายโซ่) ป้องกันการแตกตัวของสาย DNA
ไฮไลท์ คุณภาพและ เชิงปริมาณการละเมิดการสังเคราะห์โปรตีน ความสำคัญของการเปลี่ยนแปลงเชิงคุณภาพในการสังเคราะห์โปรตีนในการเกิดโรคของโรคต่างๆสามารถตัดสินได้จากตัวอย่างของโรคโลหิตจางบางประเภทที่มีลักษณะของฮีโมโกลบินทางพยาธิวิทยา การแทนที่กรดอะมิโนตกค้าง (กลูตามีน) เพียงตัวเดียวในโมเลกุลฮีโมโกลบินด้วยวาลีนทำให้เกิดโรคร้ายแรง - โรคโลหิตจางชนิดเคียว
สิ่งที่น่าสนใจเป็นพิเศษคือการเปลี่ยนแปลงเชิงปริมาณในการสังเคราะห์โปรตีนในอวัยวะและเลือด ซึ่งนำไปสู่การเปลี่ยนแปลงอัตราส่วนของเศษส่วนโปรตีนแต่ละตัวในซีรั่มในเลือด - ภาวะดิสโปรตีนในเลือดผิดปกติ ภาวะ dysproteinemia มีสองรูปแบบ: ภาวะโปรตีนในเลือดสูง(เพิ่มเนื้อหาของโปรตีนทั้งหมดหรือแต่ละประเภท) และ ภาวะโปรตีนในเลือดต่ำ(การลดเนื้อหาของโปรตีนทั้งหมดหรือแต่ละโปรตีน) ดังนั้นโรคตับจำนวนหนึ่ง (โรคตับแข็ง, ตับอักเสบ), โรคไต (โรคไตอักเสบ, โรคไต) จึงมาพร้อมกับปริมาณอัลบูมินที่ลดลงอย่างเด่นชัด โรคติดเชื้อจำนวนหนึ่งที่มาพร้อมกับกระบวนการอักเสบที่กว้างขวางทำให้ปริมาณแกมมาโกลบูลินเพิ่มขึ้น การพัฒนา ภาวะผิดปกติของโปรตีนตามกฎแล้วมาพร้อมกับการเปลี่ยนแปลงที่รุนแรงในสภาวะสมดุลของร่างกาย (ความดัน oncotic บกพร่อง, การเผาผลาญของน้ำ) การสังเคราะห์โปรตีนลดลงอย่างมีนัยสำคัญ โดยเฉพาะอัลบูมินและแกมมาโกลบูลิน ส่งผลให้ความต้านทานต่อการติดเชื้อของร่างกายลดลงอย่างรวดเร็ว และความต้านทานทางภูมิคุ้มกันลดลง ความสำคัญของภาวะโปรตีนในเลือดต่ำในรูปแบบของภาวะอัลบูมินในเลือดต่ำยังถูกกำหนดโดยข้อเท็จจริงที่ว่าอัลบูมินก่อให้เกิดสารเชิงซ้อนที่แข็งแกร่งไม่มากก็น้อยด้วย สารต่างๆสร้างความมั่นใจในการขนส่งระหว่างอวัยวะต่าง ๆ และถ่ายโอนผ่านเยื่อหุ้มเซลล์โดยมีส่วนร่วมของตัวรับเฉพาะ เป็นที่ทราบกันดีว่าเกลือของเหล็กและทองแดง (เป็นพิษอย่างยิ่งต่อร่างกาย) นั้นละลายได้ไม่ดีที่ pH ของซีรั่มในเลือดและการขนส่งสามารถทำได้ในรูปแบบของคอมเพล็กซ์ที่มีโปรตีนในซีรั่มเฉพาะ (transferrin และ ceruloplasmin) ซึ่งป้องกันพิษจากเกลือเหล่านี้ แคลเซียมประมาณครึ่งหนึ่งจะยังคงอยู่ในเลือดในรูปแบบที่จับกับซีรั่มอัลบูมิน ในกรณีนี้ สมดุลแบบไดนามิกบางอย่างถูกสร้างขึ้นในเลือดระหว่างแคลเซียมในรูปแบบที่ถูกผูกไว้กับสารประกอบที่แตกตัวเป็นไอออน ในทุกโรคที่มาพร้อมกับปริมาณอัลบูมินที่ลดลง (โรคไต) ความสามารถในการควบคุมความเข้มข้นของแคลเซียมที่แตกตัวเป็นไอออนในเลือดก็ลดลงเช่นกัน นอกจากนี้ อัลบูมินยังเป็นพาหะขององค์ประกอบบางส่วนของการเผาผลาญคาร์โบไฮเดรต (กลูโคโปรตีน) และเป็นพาหะหลักของกรดไขมันอิสระ (ไม่เอสเทอริฟายด์) และฮอร์โมนอีกจำนวนหนึ่ง
ด้วยความเสียหายต่อตับและไตกระบวนการอักเสบเฉียบพลันและเรื้อรังจำนวนหนึ่ง (โรคไขข้อ, กล้ามเนื้อหัวใจตายติดเชื้อ, โรคปอดบวม) ร่างกายเริ่มสังเคราะห์โปรตีนพิเศษที่มีคุณสมบัติที่เปลี่ยนแปลงหรือคุณสมบัติที่ผิดปกติ ตัวอย่างคลาสสิกของโรคที่เกิดจากการมีอยู่ของโปรตีนทางพยาธิวิทยาคือโรคที่เกี่ยวข้องกับการมีอยู่ของ เฮโมโกลบินทางพยาธิวิทยา(ฮีโมโกลบินโนซิส) ความผิดปกติของการแข็งตัวของเลือดเกิดขึ้นเมื่อไฟบริโนเจนทางพยาธิวิทยาปรากฏขึ้น โปรตีนในเลือดที่ผิดปกติ ได้แก่ ไครโอโกลบูลิน ซึ่งสามารถตกตะกอนที่อุณหภูมิต่ำกว่า 37°C ทำให้เกิดลิ่มเลือด การปรากฏตัวของพวกเขาจะมาพร้อมกับโรคไต, โรคตับแข็งของตับและโรคอื่น ๆ
พยาธิวิทยาของการเผาผลาญโปรตีนคั่นระหว่างหน้า(ความผิดปกติของการเผาผลาญกรดอะมิโน)
ศูนย์กลางในการเผาผลาญโปรตีนคั่นระหว่างหน้าถูกครอบครองโดยปฏิกิริยา การปนเปื้อนซึ่งเป็นแหล่งหลักในการสร้างกรดอะมิโนใหม่ การละเมิดการปนเปื้อนอาจเกิดขึ้นอันเป็นผลมาจากการขาดวิตามินบี 6 ในร่างกาย สิ่งนี้อธิบายได้จากข้อเท็จจริงที่ว่าวิตามินบี 6 ในรูปแบบฟอสโฟรีเลชั่น - ฟอสโฟไพโรดอกซาล - เป็นกลุ่มของทรานซามิเนสซึ่งเป็นเอนไซม์ทรานอะมิเนชั่นเฉพาะระหว่างกรดอะมิโนและกรดคีโต การตั้งครรภ์และการใช้ซัลโฟนาไมด์ในระยะยาวจะยับยั้งการสังเคราะห์วิตามินบี 6 และสามารถใช้เป็นพื้นฐานในการรบกวนการเผาผลาญกรดอะมิโน ในที่สุด สาเหตุของกิจกรรมการปนเปื้อนที่ลดลงอาจเกิดจากการยับยั้งกิจกรรมของทรานอะมิเนสเนื่องจากการหยุดชะงักของการสังเคราะห์เอนไซม์เหล่านี้ (ในช่วงอดอาหารโปรตีน) หรือการหยุดชะงักของการควบคุมกิจกรรมของพวกมันด้วยฮอร์โมนจำนวนหนึ่ง
กระบวนการปนเปื้อนของกรดอะมิโนมีความสัมพันธ์อย่างใกล้ชิดกับกระบวนการนี้ การปนเปื้อนออกซิเดชันในระหว่างที่ทำการกำจัดแอมโมเนียจากกรดอะมิโนด้วยเอนไซม์ การปนเปื้อนจะเป็นตัวกำหนดทั้งการก่อตัวของผลิตภัณฑ์ขั้นสุดท้ายของการเผาผลาญโปรตีนและการเข้ามาของกรดอะมิโนในการเผาผลาญพลังงาน การปนเปื้อนที่อ่อนแออาจเกิดขึ้นเนื่องจากการหยุดชะงักของกระบวนการออกซิเดชั่นในเนื้อเยื่อ (ภาวะขาดออกซิเจน, ภาวะ hypovitaminosis C, PP, B 2) อย่างไรก็ตาม การหยุดชะงักที่รุนแรงที่สุดของการปนเปื้อนเกิดขึ้นเมื่อกิจกรรมของอะมิโนออกซิเดสลดลง ไม่ว่าจะเกิดจากการสังเคราะห์ที่อ่อนแอลง (ความเสียหายของตับกระจาย การขาดโปรตีน) หรือเป็นผลมาจากความไม่เพียงพอของกิจกรรม (ปริมาณของสารอิสระที่เพิ่มขึ้น) กรดอะมิโนในเลือด) ผลที่ตามมาของการละเมิดการปนเปื้อนออกซิเดชั่นของกรดอะมิโนจะทำให้การสร้างยูเรียลดลงความเข้มข้นของกรดอะมิโนเพิ่มขึ้นและการขับถ่ายในปัสสาวะเพิ่มขึ้น - กรดอะมิโนอะซิดูเรีย
การแลกเปลี่ยนระดับกลางของกรดอะมิโนจำนวนหนึ่งเกิดขึ้นไม่เพียงแต่ในรูปของทรานอะมิเนชันและการปนเปื้อนออกซิเดชันเท่านั้น แต่ยังผ่านทางพวกมันด้วย ดีคาร์บอกซิเลชัน(การสูญเสีย CO 2 จากหมู่คาร์บอกซิล) โดยมีการก่อตัวของเอมีนที่สอดคล้องกัน เรียกว่า “ไบโอจีนิกเอมีน” ดังนั้นเมื่อฮิสทิดีนถูกดีคาร์บอกซิเลต จะเกิดฮีสตามีน ไทโรซีน - ไทรามีน 5-ไฮดรอกซีทริปโตเฟน - เซโรติน ฯลฯ เอมีนทั้งหมดนี้มีฤทธิ์ทางชีวภาพและมีผลทางเภสัชวิทยาเด่นชัดต่อหลอดเลือด
การเปลี่ยนแปลงอัตราการสลายโปรตีน- อัตราการสลายตัวของเนื้อเยื่อและโปรตีนในเลือดเพิ่มขึ้นอย่างมีนัยสำคัญสังเกตได้จากอุณหภูมิร่างกายที่เพิ่มขึ้นอย่างกว้างขวาง กระบวนการอักเสบ, การบาดเจ็บสาหัส, ภาวะขาดออกซิเจน, เนื้องอกมะเร็ง ฯลฯ ซึ่งเกี่ยวข้องกับการกระทำของสารพิษจากแบคทีเรีย (ในกรณีของการติดเชื้อ) หรือเพิ่มขึ้นอย่างมากในกิจกรรมของเอนไซม์โปรตีโอไลติกในเลือด (ในกรณีของภาวะขาดออกซิเจน) หรือผลพิษของผลิตภัณฑ์สลายเนื้อเยื่อ (กรณีได้รับบาดเจ็บ) ในกรณีส่วนใหญ่ การเร่งการสลายตัวของโปรตีนจะมาพร้อมกับการพัฒนาสมดุลของไนโตรเจนที่เป็นลบในร่างกาย เนื่องจากกระบวนการสลายโปรตีนมีความเหนือกว่าการสังเคราะห์ทางชีวภาพ
พยาธิวิทยาของขั้นตอนสุดท้ายของการเผาผลาญโปรตีน- ผลิตภัณฑ์ขั้นสุดท้ายหลักของการเผาผลาญโปรตีนคือแอมโมเนียและยูเรีย พยาธิสภาพของขั้นตอนสุดท้ายของการเผาผลาญโปรตีนสามารถเกิดขึ้นได้จากการละเมิดการก่อตัวของผลิตภัณฑ์ขั้นสุดท้ายหรือการละเมิดการขับถ่าย
กลไกหลัก การจับกับแอมโมเนียเป็นกระบวนการสร้างยูเรียในวงจรซิทรูลีน-อาร์จินินอร์นิทีน การรบกวนในการก่อตัวของยูเรียอาจเกิดขึ้นอันเป็นผลมาจากการลดลงของกิจกรรมของระบบเอนไซม์ที่เกี่ยวข้องในกระบวนการนี้ (โรคตับอักเสบ, โรคตับแข็งของตับ) และการขาดโปรตีนทั่วไป เมื่อการก่อตัวของยูเรียบกพร่อง แอมโมเนียจะสะสมในเลือดและเนื้อเยื่อ และความเข้มข้นของกรดอะมิโนอิสระจะเพิ่มขึ้น ซึ่งมาพร้อมกับการพัฒนาของภาวะน้ำตาลในเลือดสูง ในรูปแบบที่รุนแรงของโรคตับอักเสบและโรคตับแข็งของตับเมื่อฟังก์ชั่นการสร้างยูเรียของมันบกพร่องอย่างมากความเป็นพิษของแอมโมเนียอย่างรุนแรงจะเกิดขึ้น (ฟังก์ชั่นการทำงานของส่วนกลางบกพร่อง ระบบประสาท).
ในอวัยวะและเนื้อเยื่ออื่นๆ (กล้ามเนื้อ เนื้อเยื่อประสาท) แอมโมเนียจับกับปฏิกิริยาอะมิเดชันด้วยการเติมกรดอะมิโนไดคาร์บอกซิลิกอิสระให้กับหมู่คาร์บอกซิล สารตั้งต้นหลักคือกรดกลูตามิก
ผลิตภัณฑ์ขั้นสุดท้ายอีกประการหนึ่งของการเผาผลาญโปรตีนที่เกิดขึ้นระหว่างการเกิดออกซิเดชัน ครีเอทีน(สารไนโตรเจนในกล้ามเนื้อ) คือ ครีเอตินีน ช่วงอดอาหาร ขาดวิตามินอี ไข้สูง โรคติดเชื้อ, thyrotoxicosis และโรคอื่น ๆ อีกจำนวนหนึ่ง creatinuria บ่งบอกถึงการละเมิดการเผาผลาญของครีเอทีน
เมื่อการทำงานของไตบกพร่อง (ไตอักเสบ) ยูเรียและผลิตภัณฑ์ไนโตรเจนอื่น ๆ จะยังคงอยู่ในเลือด ไนโตรเจนที่ตกค้างเพิ่มขึ้น - ภาวะน้ำตาลในเลือดสูงพัฒนา ระดับสูงสุดของการด้อยค่าของการขับถ่ายของสารไนโตรเจนคือภาวะยูเรีย
ด้วยความเสียหายต่อตับและไตพร้อมกันทำให้เกิดการละเมิดการก่อตัวและการปลดปล่อยผลิตภัณฑ์สุดท้ายของการเผาผลาญโปรตีน
ในการปฏิบัติงานด้านกุมารเวชศาสตร์ aminoacidopathies ทางพันธุกรรมมีความสำคัญเป็นพิเศษซึ่งรายการในปัจจุบันมีรูปแบบทาง nosological ที่แตกต่างกันประมาณ 60 รูปแบบ ตามประเภทของมรดก เกือบทั้งหมดเป็นแบบถอยแบบออโตโซม กลไกการเกิดโรคเกิดจากการขาดเอนไซม์อย่างน้อยหนึ่งเอนไซม์ที่ทำหน้าที่แคแทบอลิซึมและแอแนบอลิซึมของกรดอะมิโน สัญญาณทางชีวเคมีที่พบบ่อยของภาวะกรดอะมิโนคือภาวะกรดในเนื้อเยื่อและภาวะกรดอะมิโนในดูเรีย ข้อบกพร่องทางเมแทบอลิซึมทางพันธุกรรมที่พบบ่อยที่สุดคือเอนไซม์สี่ชนิดซึ่งสัมพันธ์กันโดยวิถีเมแทบอลิซึมของกรดอะมิโน: ฟีนิลคีโตนูเรีย, ไทโรซิเนเมีย, เผือก, อัลแคปโตนูเรีย
คาร์โบไฮเดรตถือเป็นส่วนบังคับและสำคัญของอาหารมนุษย์ (ประมาณ 500 กรัม/วัน) คาร์โบไฮเดรตเป็นวัสดุที่เคลื่อนย้ายและนำไปใช้ได้ง่ายที่สุด พวกมันจะถูกเก็บไว้ในรูปของไกลโคเจนและไขมัน ในระหว่างการเผาผลาญคาร์โบไฮเดรต NADP·H 2 จะเกิดขึ้น คาร์โบไฮเดรตมีบทบาทพิเศษในพลังงานของระบบประสาทส่วนกลางเนื่องจากกลูโคสเป็น แหล่งที่มาเดียวพลังงานสำหรับสมอง
ความผิดปกติของการเผาผลาญคาร์โบไฮเดรตอาจเกิดจากการละเมิดการย่อยอาหารและการดูดซึมในระบบทางเดินอาหาร คาร์โบไฮเดรตภายนอกเข้าสู่ร่างกายในรูปแบบของโพลี-, ได- และโมโนแซ็กคาไรด์ การสลายส่วนใหญ่เกิดขึ้นในลำไส้เล็กส่วนต้นและลำไส้เล็กซึ่งน้ำผลไม้นั้นมีเอนไซม์อะไมโลไลติกที่ใช้งานอยู่ (อะไมเลส, มอลตา, ซูเครส, แลคเตส, อินเวอร์เตส ฯลฯ ) คาร์โบไฮเดรตจะถูกย่อยเป็นโมโนแซ็กคาไรด์และดูดซึม หากการผลิตเอนไซม์อะไมโลไลติกไม่เพียงพอ ไดและโพลีแซ็กคาไรด์ที่มาพร้อมกับอาหารจะไม่ถูกย่อยเป็นโมโนแซ็กคาไรด์และไม่ถูกดูดซึม การดูดซึมกลูโคสจะทนทุกข์ทรมานเมื่อฟอสโฟรีเลชั่นในผนังลำไส้บกพร่อง พื้นฐานของความผิดปกตินี้คือการขาดเอนไซม์เฮกโซไคเนสซึ่งพัฒนาในระหว่างกระบวนการอักเสบอย่างรุนแรงในลำไส้ในกรณีที่เป็นพิษกับ monoiodoacetate, phloridzin กลูโคสที่ไม่มีฟอสโฟรีเลชั่นจะไม่ผ่านผนังลำไส้และไม่ถูกดูดซึม อาจเกิดความอดอยากจากคาร์โบไฮเดรต
การสังเคราะห์และการสลายไกลโคเจนบกพร่อง- การเพิ่มขึ้นของทางพยาธิวิทยาในการสลายตัวของไกลโคเจนเกิดขึ้นจากการกระตุ้นอย่างรุนแรงของระบบประสาทส่วนกลางโดยมีการเพิ่มขึ้นของกิจกรรมของฮอร์โมนที่กระตุ้นไกลโคเจนโนไลซิส (GH, อะดรีนาลีน, กลูคากอน, ไทรอกซีน) การสลายตัวของไกลโคเจนที่เพิ่มขึ้นในขณะที่การบริโภคกลูโคสในกล้ามเนื้อเพิ่มขึ้นเกิดขึ้นในระหว่างที่กล้ามเนื้อมีภาระหนัก การสังเคราะห์ไกลโคเจนอาจเปลี่ยนไปลดลงหรือเพิ่มขึ้นทางพยาธิวิทยา
การสังเคราะห์ไกลโคเจนที่ลดลงเกิดขึ้นกับความเสียหายอย่างรุนแรงต่อเซลล์ตับ (ตับอักเสบ, พิษจากพิษของตับ) เมื่อฟังก์ชั่นการสร้างไกลโคเจนหยุดชะงัก การสังเคราะห์ไกลโคเจนจะลดลงในระหว่างที่ขาดออกซิเจนเนื่องจากภายใต้ภาวะขาดออกซิเจนการก่อตัวของ ATP ซึ่งจำเป็นสำหรับการสังเคราะห์ไกลโคเจนจะลดลง
น้ำตาลในเลือดสูง- ระดับน้ำตาลในเลือดเพิ่มขึ้นสูงกว่าปกติ สามารถพัฒนาได้ภายใต้สภาวะทางสรีรวิทยา ในขณะเดียวกันก็มีความสำคัญในการปรับตัว เนื่องจากช่วยให้แน่ใจว่าการส่งวัสดุพลังงานไปยังเนื้อเยื่อ ภาวะน้ำตาลในเลือดสูงประเภทต่อไปนี้ขึ้นอยู่กับปัจจัยสาเหตุ
ภาวะน้ำตาลในเลือดสูงทางโภชนาการ ซึ่งเกิดขึ้นหลังจากรับประทานคาร์โบไฮเดรตที่ย่อยง่ายจำนวนมาก (น้ำตาล ขนมหวาน ผลิตภัณฑ์จากแป้ง ฯลฯ)
น้ำตาลในเลือดสูงทางระบบประสาท (อารมณ์) - ด้วยความเร้าอารมณ์ทางอารมณ์, ความเครียด, ความเจ็บปวด, การดมยาสลบอีเทอร์
ภาวะน้ำตาลในเลือดสูงของฮอร์โมนมาพร้อมกับความผิดปกติของต่อมไร้ท่อซึ่งเป็นฮอร์โมนที่เกี่ยวข้องกับการควบคุมการเผาผลาญคาร์โบไฮเดรต
ภาวะน้ำตาลในเลือดสูงที่มีฮอร์โมนอินซูลินไม่เพียงพอจะเด่นชัดและต่อเนื่องที่สุด อาจเป็นตับอ่อน (สัมบูรณ์) และนอกตับอ่อน (ญาติ)
การขาดอินซูลินในตับอ่อนพัฒนาเมื่ออุปกรณ์โดดเดี่ยวของตับอ่อนถูกทำลายหรือเสียหาย สาเหตุที่พบบ่อยคือภาวะขาดออกซิเจนในท้องถิ่นของเกาะเล็กเกาะน้อย Langerhans ในระหว่างหลอดเลือดและกล้ามเนื้อกระตุกของหลอดเลือด ในกรณีนี้การก่อตัวของพันธะซัลไฟด์ในอินซูลินจะหยุดชะงักและอินซูลินจะสูญเสียกิจกรรม - ไม่มีผลต่อภาวะน้ำตาลในเลือด
การขาดอินซูลินอาจเป็นผลมาจากการทำลายตับอ่อนด้วยเนื้องอกหรือความเสียหายต่อตับอ่อนโดยกระบวนการติดเชื้อ (วัณโรค, ซิฟิลิส) การก่อตัวของอินซูลินสามารถหยุดชะงักได้ในระหว่างตับอ่อนอักเสบ - กระบวนการอักเสบเฉียบพลันและความเสื่อมในตับอ่อน
อุปกรณ์ที่แยกตัวออกมาจะทำงานหนักเกินไปและอาจหมดลงได้เนื่องจากการบริโภคคาร์โบไฮเดรตที่ย่อยง่าย (น้ำตาล ขนมหวาน) มากเกินไปและบ่อยครั้ง หรือการรับประทานอาหารมากเกินไป ซึ่งนำไปสู่ภาวะน้ำตาลในเลือดสูงทางโภชนาการ
แถว ยา(กลุ่มของไทอาไซด์ คอร์ติโคสเตียรอยด์ ฯลฯ) อาจทำให้ความทนทานต่อกลูโคสบกพร่อง และในผู้ที่มีแนวโน้มจะเป็นโรคเบาหวานอาจเป็นปัจจัยกระตุ้นให้เกิดโรคนี้ได้
การขาดอินซูลินนอกตับอ่อน- อาจเกิดจากการที่อินซูลินจับกับโปรตีนในการขนส่งเลือดมากเกินไป อินซูลินที่จับกับโปรตีนนั้นออกฤทธิ์เฉพาะกับเนื้อเยื่อไขมันเท่านั้น ช่วยให้มั่นใจว่าการเปลี่ยนกลูโคสเป็นไขมันและยับยั้งการสลายไขมัน ในกรณีนี้สิ่งที่เรียกว่าโรคเบาหวานโรคอ้วนจะพัฒนาขึ้น
ที่ โรคเบาหวานระบบเผาผลาญทุกประเภทหยุดชะงัก
ความผิดปกติของการเผาผลาญคาร์โบไฮเดรตกำหนด อาการลักษณะเฉพาะโรคเบาหวาน - ภาวะน้ำตาลในเลือดสูงอย่างรุนแรงถาวร มันถูกกำหนดโดยคุณสมบัติของการเผาผลาญคาร์โบไฮเดรตในผู้ป่วยโรคเบาหวานดังต่อไปนี้: ลดการส่งผ่านของกลูโคสผ่านเยื่อหุ้มเซลล์และการดูดซึมโดยเนื้อเยื่อ ชะลอการสังเคราะห์ไกลโคเจนและเร่งการสลายตัว เพิ่มการสร้างกลูโคส - การก่อตัวของกลูโคสจากแลคเตต, ไพรูเวต, กรดอะมิโนและผลิตภัณฑ์อื่น ๆ ของการเผาผลาญที่ไม่ใช่คาร์โบไฮเดรต; ยับยั้งการเปลี่ยนกลูโคสเป็นไขมัน
ความสำคัญของภาวะน้ำตาลในเลือดสูงในการเกิดโรคของโรคเบาหวานนั้นมีสองเท่า มันมีบทบาทในการปรับตัวบางอย่างเนื่องจากมันยับยั้งการสลายไกลโคเจนและเพิ่มการสังเคราะห์บางส่วน กลูโคสแทรกซึมเข้าไปในเนื้อเยื่อได้ง่ายขึ้นและไม่ได้ขาดคาร์โบไฮเดรตมากนัก น้ำตาลในเลือดสูงก็มีความหมายเชิงลบเช่นกัน ด้วยเหตุนี้ปริมาณกลูโคสเข้าสู่เซลล์ของเนื้อเยื่อที่ไม่ขึ้นกับอินซูลิน (เลนส์, เซลล์ตับ, เซลล์เบต้าของเกาะเล็กเกาะ Langerhans, เนื้อเยื่อประสาท, เซลล์เม็ดเลือดแดง, ผนังหลอดเลือด) เพิ่มขึ้นอย่างรวดเร็ว กลูโคสส่วนเกินจะไม่ถูกเปลี่ยนเป็นฟอสโฟรีเลชั่น แต่จะเปลี่ยนเป็นซอร์บิทอลและฟรุกโตส มันเป็นออสโมติก สารออกฤทธิ์ขัดขวางการเผาผลาญในเนื้อเยื่อเหล่านี้และทำให้เกิดความเสียหาย เมื่อมีภาวะน้ำตาลในเลือดสูง ความเข้มข้นของกลูโคและมิวโคโปรตีนจะเพิ่มขึ้น ซึ่งสามารถตกตะกอนได้ง่าย เนื้อเยื่อเกี่ยวพัน,ส่งเสริมการสร้างไฮยาลีน
เมื่อระดับน้ำตาลในเลือดสูงเกิน 8 โมลต่อลิตร กลูโคสจะเริ่มผ่านเข้าสู่ปัสสาวะสุดท้าย - กลูโคสจะพัฒนาขึ้น นี่คืออาการของการชดเชยการเผาผลาญคาร์โบไฮเดรต
ในโรคเบาหวาน กระบวนการฟอสโฟรีเลชั่นและดีฟอสโฟรีเลชั่นของกลูโคสในท่อไม่สามารถรับมือกับกลูโคสส่วนเกินในปัสสาวะปฐมภูมิได้ นอกจากนี้กิจกรรมของเฮกโซไคเนสจะลดลงในผู้ป่วยเบาหวาน ดังนั้นเกณฑ์การทำงานของไตสำหรับกลูโคสจึงต่ำกว่าปกติ กลูโคซูเรียพัฒนาขึ้น ในรูปแบบที่รุนแรงของโรคเบาหวาน ปริมาณน้ำตาลในปัสสาวะอาจสูงถึง 8-10% ในเวลาเดียวกัน แรงดันออสโมติกของปัสสาวะจะเพิ่มขึ้น ดังนั้นน้ำจำนวนมากจึงผ่านเข้าไปในปัสสาวะสุดท้าย ปัสสาวะถูกขับออกมา 5-10 ลิตรหรือมากกว่าต่อวัน (โพลียูเรีย) โดยมีความหนาแน่นสัมพัทธ์สูงเนื่องจากน้ำตาล อันเป็นผลมาจากภาวะ polyuria ทำให้ร่างกายขาดน้ำและเป็นผลให้กระหายน้ำมากขึ้น (polydipsia)
อย่างมาก ระดับสูงระดับน้ำตาลในเลือด (30-50 โมล/ลิตรขึ้นไป) ความดันออสโมติกของเลือดจะเพิ่มขึ้นอย่างรวดเร็ว ส่งผลให้ร่างกายขาดน้ำ อาการโคม่า Hyperosmolar อาจเกิดขึ้น สภาพของผู้ป่วยนั้นร้ายแรงมาก ไม่มีจิตสำนึก สัญญาณของการขาดน้ำของเนื้อเยื่อจะแสดงออกมาอย่างชัดเจน (ลูกตาอ่อนเมื่อคลำ) ภาวะน้ำตาลในเลือดสูงสูงมาก ระดับคีโตนในร่างกายจึงใกล้เคียงกับปกติ ผลจากการขาดน้ำ ไตถูกทำลายและการทำงานของไตบกพร่อง นำไปสู่ภาวะไตวาย
การเปลี่ยนแปลงทางพยาธิวิทยาในการเผาผลาญไขมันสามารถเกิดขึ้นได้ในขั้นตอนต่าง ๆ : เมื่อกระบวนการย่อยและการดูดซึมไขมันหยุดชะงัก ในกรณีที่การขนส่งไขมันหยุดชะงักและการเปลี่ยนเป็นเนื้อเยื่อ ในกรณีที่มีการละเมิดออกซิเดชันของไขมันในเนื้อเยื่อ ในกรณีที่การหยุดชะงักของการเผาผลาญไขมันระดับกลาง หากมีการละเมิดการเผาผลาญไขมันในเนื้อเยื่อไขมัน (การก่อตัวและการสะสมมากเกินไปหรือไม่เพียงพอ)
การละเมิดกระบวนการย่อยและดูดซึมไขมันสังเกต:
1. ขาดไลเปสตับอ่อน
2. มีภาวะขาดกรดน้ำดี (การอักเสบของถุงน้ำดี, การอุดตันของท่อน้ำดี, โรคตับ) การอิมัลซิฟิเคชั่นของไขมัน การกระตุ้นการทำงานของไลเปสตับอ่อน และการก่อตัวของเปลือกนอกของไมเซลล์ผสม ซึ่งกรดไขมันและโมโนกลีเซอไรด์ที่สูงขึ้นจะถูกถ่ายโอนจากบริเวณที่มีการไฮโดรไลซิสของไขมันไปยังพื้นผิวการดูดซึมของเยื่อบุผิวในลำไส้ จะถูกรบกวน
3. มีการบีบตัวของลำไส้เล็กเพิ่มขึ้นและความเสียหายต่อเยื่อบุของลำไส้เล็กด้วยสารติดเชื้อและสารพิษ
4. เมื่อมีแคลเซียมและแมกนีเซียมไอออนมากเกินไปในอาหารเมื่อมีเกลือของกรดน้ำดีที่ไม่ละลายน้ำ - สบู่ - เกิดขึ้น
5. การขาดวิตามิน A และ B การขาดโคลีน ตลอดจนการรบกวนกระบวนการฟอสโฟรีเลชั่น (ยับยั้งการดูดซึมไขมัน)
อันเป็นผลมาจากการดูดซึมไขมันที่บกพร่อง steatorrhea พัฒนาขึ้น (อุจจาระมีกรดไขมันสูงกว่าและไขมันที่ไม่ได้ย่อยจำนวนมาก) แคลเซียมก็สูญเสียไปพร้อมกับไขมันด้วย
การไฮโดรไลซิสและการดูดซึมโปรตีนในอาหารในระบบทางเดินอาหาร
การรบกวนขั้นตอนแรกของการเผาผลาญโปรตีน
ในกระเพาะอาหารและลำไส้การย่อยสลายโปรตีนในอาหารแบบไฮโดรไลติกเป็นเปปไทด์และกรดอะมิโนเกิดขึ้นภายใต้อิทธิพลของเอนไซม์จากน้ำย่อย (เปปซิน), ตับอ่อน (ทริปซิน, ไคโมทริปซิน, อะมิโนเปปไทเดสและคาร์บอกซีเพปทิเดส) และน้ำผลไม้ในลำไส้ (อะมิโนเปปติเดส, ไดเพปทิเดส) กรดอะมิโนที่เกิดขึ้นระหว่างการสลายโปรตีนจะถูกดูดซึมโดยผนังลำไส้เล็กเข้าสู่กระแสเลือดและถูกใช้โดยเซลล์ของอวัยวะต่างๆ การหยุดชะงักของกระบวนการเหล่านี้เกิดขึ้นในโรคของกระเพาะอาหาร (กระบวนการอักเสบและเป็นแผล, เนื้องอก), ตับอ่อน (ตับอ่อนอักเสบ, การอุดตันของท่อ, มะเร็ง), ลำไส้เล็ก (ลำไส้อักเสบ, ท้องเสีย, ฝ่อ) การแทรกแซงการผ่าตัดอย่างกว้างขวางเช่นการกำจัดกระเพาะอาหาร หรือส่วนสำคัญของลำไส้เล็กจะมาพร้อมกับการละเมิดการสลายและการดูดซึมโปรตีนในอาหาร การดูดซึมโปรตีนในอาหารจะลดลงในช่วงมีไข้เนื่องจากการหลั่งเอนไซม์ย่อยอาหารลดลง
เมื่อการหลั่งกรดไฮโดรคลอริกในกระเพาะอาหารลดลง การบวมของโปรตีนในกระเพาะอาหารและการเปลี่ยนเปปซิโนเจนเป็นเปปซินจะลดลง เนื่องจากการอพยพอาหารออกจากกระเพาะอาหารอย่างรวดเร็ว โปรตีนจึงไม่สามารถไฮโดรไลซ์เป็นเปปไทด์ได้เพียงพอ เช่น โปรตีนบางชนิดเข้าสู่ลำไส้เล็กส่วนต้นไม่เปลี่ยนแปลง นอกจากนี้ยังรบกวนการไฮโดรไลซิสของโปรตีนในลำไส้อีกด้วย
การดูดซึมโปรตีนในอาหารไม่เพียงพอนั้นมาพร้อมกับการขาดกรดอะมิโนและการสังเคราะห์โปรตีนของตัวเองบกพร่อง การขาดโปรตีนในอาหารไม่สามารถชดเชยได้อย่างเต็มที่ด้วยการบริหารและการดูดซึมสารอื่นๆ ที่มากเกินไป เนื่องจากโปรตีนเป็นแหล่งไนโตรเจนหลักสำหรับร่างกาย
การสังเคราะห์โปรตีนเกิดขึ้นในร่างกายอย่างต่อเนื่องตลอดชีวิต แต่เกิดขึ้นอย่างเข้มข้นที่สุดในช่วง การพัฒนามดลูกในวัยเด็กและวัยรุ่น
สาเหตุของความผิดปกติในการสังเคราะห์โปรตีนคือ:
ขาดกรดอะมิโนเพียงพอ
การขาดพลังงานในเซลล์
ความผิดปกติของการควบคุมระบบประสาทต่อมไร้ท่อ
การหยุดชะงักของกระบวนการถอดรหัสหรือการแปลข้อมูลเกี่ยวกับโครงสร้างของโปรตีนเฉพาะที่เข้ารหัสในจีโนมของเซลล์
สาเหตุที่พบบ่อยที่สุดของความผิดปกติในการสังเคราะห์โปรตีนคือ ขาดกรดอะมิโนในร่างกายเนื่องจาก:
1) ความผิดปกติของการย่อยอาหารและการดูดซึม
2) ปริมาณโปรตีนในอาหารต่ำ
3) โภชนาการที่มีโปรตีนไม่สมบูรณ์ซึ่งขาดหรือมีกรดอะมิโนจำเป็นจำนวนเล็กน้อยที่ไม่ได้สังเคราะห์ในร่างกาย
กรดอะมิโนจำเป็นครบชุดพบได้ในโปรตีนจากสัตว์ส่วนใหญ่ ในขณะที่โปรตีนจากพืชอาจขาดหรือมีบางส่วนอยู่ (เช่น โปรตีนจากข้าวโพดมีทริปโตเฟนต่ำ) ตำหนิในร่างกายอย่างน้อยหนึ่งอย่าง กรดอะมิโนที่จำเป็นนำไปสู่การสังเคราะห์โปรตีนหนึ่งหรืออย่างอื่นลดลงแม้ว่าจะมีโปรตีนชนิดอื่นมากมายก็ตาม กรดอะมิโนที่จำเป็น ได้แก่ ทริปโตเฟน ไลซีน เมไทโอนีน ไอโซลิวซีน ลิวซีน วาลีน ฟีนิลอะลานีน ธรีโอนีน ฮิสทิดีน อาร์จินีน
การขาดกรดอะมิโนที่จำเป็นในอาหารมักนำไปสู่การสังเคราะห์โปรตีนลดลงเนื่องจากสามารถเกิดขึ้นในร่างกายได้จากกรดคีโตซึ่งเป็นผลิตภัณฑ์จากการเผาผลาญคาร์โบไฮเดรตไขมันและโปรตีน
ขาดกรดคีโตเกิดขึ้นกับโรคเบาหวาน, การหยุดชะงักของกระบวนการปนเปื้อนและการปนเปื้อนของกรดอะมิโน (hypovitaminosis B 6)
ขาดแหล่งพลังงานเกิดขึ้นกับภาวะขาดออกซิเจน, การกระทำของปัจจัยแยกส่วน, เบาหวาน, ภาวะขาดวิตามิน B1, การขาด กรดนิโคตินิกเป็นต้น การสังเคราะห์โปรตีนเป็นกระบวนการที่ต้องอาศัยพลังงาน
ความผิดปกติของการควบคุมระบบประสาทต่อมไร้ท่อของการสังเคราะห์โปรตีนและการสลายระบบประสาทมีผลทั้งทางตรงและทางอ้อมต่อการเผาผลาญโปรตีน เมื่อสูญเสียอิทธิพลของเส้นประสาท ความผิดปกติของเซลล์โภชนาการจะเกิดขึ้น การเสื่อมของเนื้อเยื่อสาเหตุ: การหยุดการกระตุ้นเนื่องจากการหยุดชะงักของการปล่อยสารสื่อประสาท การหลั่งหรือการกระทำที่บกพร่องของนักแสดงตลกที่ให้การควบคุมกระบวนการรับ เมมเบรน และเมแทบอลิซึม การหยุดชะงักของการปล่อยและการออกฤทธิ์ของโทรโฟเจน
การออกฤทธิ์ของฮอร์โมนสามารถทำให้เกิดอะนาโบลิกได้(เพิ่มการสังเคราะห์โปรตีน) และ แคแทบอลิซึม(เพิ่มการสลายโปรตีนในเนื้อเยื่อ)
การสังเคราะห์โปรตีนเพิ่มขึ้นภายใต้อิทธิพลของ:
อินซูลิน (ให้การขนส่งกรดอะมิโนจำนวนมากเข้าสู่เซลล์โดยเฉพาะอย่างยิ่งวาลีน, ลิวซีน, ไอโซลิวซีน; เพิ่มอัตราการถอดรหัส DNA ในนิวเคลียส; กระตุ้นการประกอบและการแปลของไรโบโซม; ยับยั้งการใช้กรดอะมิโนในการสร้างกลูโคนีโอเนซิส, เพิ่มกิจกรรมไมโทติคของอินซูลิน - เนื้อเยื่อขึ้นอยู่กับการเพิ่มการสังเคราะห์ DNA และ RNA);
ฮอร์โมน Somatotropic (GH; ผลการเจริญเติบโตนั้นถูกสื่อกลางโดย somatomedins ที่ผลิตภายใต้อิทธิพลของมันในตับ) ตัวหลักคือ somatomedin C ซึ่งจะเพิ่มอัตราการสังเคราะห์โปรตีนในทุกเซลล์ของร่างกาย ซึ่งจะช่วยกระตุ้นการสร้างกระดูกอ่อนและเนื้อเยื่อของกล้ามเนื้อ Chondrocytes ยังมีตัวรับฮอร์โมนการเจริญเติบโตซึ่งพิสูจน์ผลโดยตรงต่อกระดูกอ่อนและเนื้อเยื่อกระดูก
ฮอร์โมนไทรอยด์ในปริมาณทางสรีรวิทยา: ไตรไอโอโดไทโรนีนซึ่งจับกับตัวรับในนิวเคลียสของเซลล์ทำหน้าที่กับจีโนมและทำให้เกิดการถอดรหัสและการแปลเพิ่มขึ้น ส่งผลให้กระตุ้นการสังเคราะห์โปรตีนในทุกเซลล์ของร่างกาย นอกจากนี้ฮอร์โมนไทรอยด์ยังกระตุ้นการทำงานของ GH;
ฮอร์โมนเพศที่มีผลต่อการสังเคราะห์โปรตีนที่ขึ้นกับฮอร์โมนการเจริญเติบโต แอนโดรเจนกระตุ้นการสร้างโปรตีนในอวัยวะสืบพันธุ์ชาย กล้ามเนื้อ โครงกระดูก ผิวหนัง และอนุพันธ์ของมัน และในไตและสมองในระดับที่น้อยกว่า การออกฤทธิ์ของเอสโตรเจนมุ่งตรงไปที่ต่อมน้ำนมและอวัยวะสืบพันธุ์สตรีเป็นหลัก ควรสังเกตว่าผลอะนาโบลิกของฮอร์โมนเพศไม่ส่งผลต่อการสังเคราะห์โปรตีนในตับ
การสลายโปรตีนเพิ่มขึ้นภายใต้อิทธิพลของ:
ฮอร์โมนไทรอยด์ที่มีการผลิตเพิ่มขึ้น (hyperthyroidism);
กลูคากอน (ลดการดูดซึมของกรดอะมิโนและเพิ่มการสลายโปรตีนในกล้ามเนื้อ; กระตุ้นการทำงานของโปรตีโอไลซิสในตับและยังกระตุ้นการสร้างกลูโคโนเจเนซิสและคีโตเจเนซิสจากกรดอะมิโน; ยับยั้งผลอะนาโบลิกของฮอร์โมนการเจริญเติบโต);
Catecholamines (ส่งเสริมการสลายตัวของโปรตีนของกล้ามเนื้อด้วยการระดมกรดอะมิโนและการใช้งานโดยตับ);
กลูโคคอร์ติคอยด์ (เพิ่มการสังเคราะห์โปรตีนและกรดนิวคลีอิกในตับและเพิ่มการสลายโปรตีนในกล้ามเนื้อ ผิวหนัง กระดูก น้ำเหลือง และเนื้อเยื่อไขมันด้วยการปล่อยกรดอะมิโนและการมีส่วนร่วมในการสร้างกลูโคนีโอเจเนซิส นอกจากนี้ยังยับยั้งการขนส่งของ กรดอะมิโนเข้าสู่เซลล์กล้ามเนื้อลดการสังเคราะห์โปรตีน)
ผลของฮอร์โมนอะนาโบลิกส่วนใหญ่เกิดขึ้นจากการกระตุ้นการทำงานของยีนบางชนิดและการก่อตัวที่เพิ่มขึ้น ประเภทต่างๆ RNA (สาร, การขนส่ง, ไรโบโซม) ซึ่งเร่งการสังเคราะห์โปรตีน กลไกการออกฤทธิ์ของ catabolic ของฮอร์โมนนั้นสัมพันธ์กับการเพิ่มขึ้นของกิจกรรมของโปรตีเอสของเนื้อเยื่อ
การสังเคราะห์โปรตีนที่ลดลงอย่างมีนัยสำคัญในระยะยาวนำไปสู่การพัฒนาความผิดปกติของ dystrophic และ atrophic ในอวัยวะและเนื้อเยื่อต่าง ๆ เนื่องจากการต่ออายุไม่เพียงพอ โปรตีนโครงสร้าง- กระบวนการฟื้นฟูช้าลง ในวัยเด็ก การเจริญเติบโต พัฒนาการทางร่างกายและจิตใจจะถูกขัดขวาง การสังเคราะห์เอนไซม์และฮอร์โมนต่างๆ (GH, ยาขับปัสสาวะและฮอร์โมนไทรอยด์, อินซูลิน ฯลฯ ) จะลดลง ซึ่งนำไปสู่โรคต่อมไร้ท่อและการหยุดชะงักของการเผาผลาญประเภทอื่น ๆ (คาร์โบไฮเดรต, เกลือน้ำ, ฐาน) ปริมาณโปรตีนในซีรั่มในเลือดลดลงเนื่องจากการสังเคราะห์ในเซลล์ตับลดลง การผลิตแอนติบอดีและโปรตีนป้องกันอื่นๆ ลดลง และเป็นผลให้ปฏิกิริยาทางภูมิคุ้มกันของร่างกายลดลง
สาเหตุและกลไกของการหยุดชะงักของการสังเคราะห์โปรตีนแต่ละชนิดในกรณีส่วนใหญ่ความผิดปกติเหล่านี้เป็นกรรมพันธุ์ ขึ้นอยู่กับการไม่มีเซลล์ของ Messenger RNA (mRNA) ซึ่งเป็นเมทริกซ์เฉพาะสำหรับการสังเคราะห์โปรตีนชนิดใดชนิดหนึ่งหรือการละเมิดโครงสร้างเนื่องจากการเปลี่ยนแปลงโครงสร้างของยีนที่สังเคราะห์ขึ้น ความผิดปกติทางพันธุกรรม เช่น การแทนที่หรือการสูญเสียนิวคลีโอไทด์หนึ่งตัวในยีนโครงสร้าง นำไปสู่การสังเคราะห์โปรตีนที่เปลี่ยนแปลง ซึ่งมักไม่มีกิจกรรมทางชีวภาพ
การก่อตัวของโปรตีนที่ผิดปกติอาจเกิดจากการเบี่ยงเบนจากบรรทัดฐานในโครงสร้างของ mRNA การกลายพันธุ์ของการถ่ายโอน RNA (tRNA) ซึ่งเป็นผลมาจากการเติมกรดอะมิโนที่ไม่เหมาะสมเข้าไปซึ่งจะรวมอยู่ในสายโซ่โพลีเปปไทด์ระหว่าง การประกอบ (ตัวอย่างเช่น ระหว่างการก่อตัวของฮีโมโกลบิน)
สาเหตุ กลไก และผลที่ตามมาของการสลายโปรตีนในเนื้อเยื่อที่เพิ่มขึ้นนอกจากการสังเคราะห์ในเซลล์ของร่างกายแล้ว การย่อยสลายโปรตีนยังเกิดขึ้นอย่างต่อเนื่องภายใต้การทำงานของโปรตีเอสเอส การต่ออายุโปรตีนต่อวันในผู้ใหญ่คือ 1-2% ของปริมาณโปรตีนทั้งหมดในร่างกายและสัมพันธ์กับการย่อยสลายโปรตีนของกล้ามเนื้อเป็นหลัก ในขณะที่ 75-80% ของกรดอะมิโนที่ปล่อยออกมาจะถูกนำไปใช้ในการสังเคราะห์อีกครั้ง