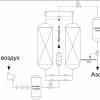
มาสร้างสูตรเกลือกันดีกว่า คู่มือครูสอนเคมี ดาน่า ซิงค์ คอปเปอร์ ซิงค์ออกไซด์
สังกะสีเป็นองค์ประกอบของกลุ่มย่อยรองของกลุ่มที่สองซึ่งเป็นช่วงที่สี่ของระบบธาตุเคมีของ D.I. Mendeleev โดยมีเลขอะตอม 30 ถูกกำหนดโดยสัญลักษณ์ Zn (lat. Zincum) สารสังกะสีอย่างง่ายภายใต้สภาวะปกติคือโลหะทรานซิชันสีน้ำเงินที่เปราะ สีขาว(จางหายไปในอากาศ กลายเป็นชั้นสังกะสีออกไซด์บางๆ ปกคลุมอยู่)
ในช่วงที่สี่ สังกะสีคือธาตุ d สุดท้าย ซึ่งเป็นธาตุเวเลนซ์อิเล็กตรอน 3d 10 4s 2 . มีเพียงอิเล็กตรอนจากระดับพลังงานภายนอกเท่านั้นที่มีส่วนร่วมในการก่อตัวของพันธะเคมี เนื่องจากการกำหนดค่า d 10 มีความเสถียรมาก ในสารประกอบ สังกะสีมีสถานะออกซิเดชันที่ +2
สังกะสีเป็นโลหะที่ออกฤทธิ์ทางเคมี มีคุณสมบัติในการรีดิวซ์เด่นชัด และมีฤทธิ์ด้อยกว่าโลหะอัลคาไลน์เอิร์ท แสดงคุณสมบัติแอมโฟเทอริก
ปฏิกิริยาระหว่างสังกะสีกับอโลหะ
เมื่อได้รับความร้อนสูงในอากาศ จะเผาไหม้ด้วยเปลวไฟสีฟ้าสดใสจนเกิดเป็นซิงค์ออกไซด์:
2Zn + O 2 → 2ZnO
เมื่อติดไฟจะทำปฏิกิริยาอย่างแรงกับซัลเฟอร์:
สังกะสี + S → สังกะสีS
ทำปฏิกิริยากับฮาโลเจนเมื่อ สภาวะปกติเมื่อมีไอน้ำเป็นตัวเร่งปฏิกิริยา:
สังกะสี + Cl 2 → สังกะสี 2 .
เมื่อไอฟอสฟอรัสทำปฏิกิริยากับสังกะสี จะเกิดฟอสไฟด์:
สังกะสี + 2P → ZnP 2 หรือ 3Zn + 2P → Zn 3 P 2
สังกะสีไม่มีปฏิกิริยากับไฮโดรเจน ไนโตรเจน โบรอน ซิลิคอน หรือคาร์บอน
ปฏิกิริยาระหว่างสังกะสีกับน้ำ
ทำปฏิกิริยากับไอน้ำที่ความร้อนแดงทำให้เกิดซิงค์ออกไซด์และไฮโดรเจน:
สังกะสี + H 2 O → ZnO + H 2 .
ปฏิกิริยาระหว่างสังกะสีกับกรด
ในชุดโลหะแรงดันไฟฟ้าเคมีไฟฟ้า สังกะสีจะอยู่ก่อนไฮโดรเจนและแทนที่จากกรดที่ไม่ออกซิไดซ์:
สังกะสี + 2HCl → สังกะสี 2 + H 2 ;
สังกะสี + H 2 SO 4 → ZnSO 4 + H 2 .
ทำปฏิกิริยากับกรดไนตริกเจือจางเพื่อสร้างซิงค์ไนเตรตและแอมโมเนียมไนเตรต:
4Zn + 10HNO 3 → 4Zn(NO 3) 2 + NH 4 NO 3 + 3H 2 O
ทำปฏิกิริยากับกรดซัลฟิวริกและกรดไนตริกเข้มข้นเพื่อสร้างเกลือสังกะสีและผลิตภัณฑ์ลดกรด:
สังกะสี + 2H 2 SO 4 → ZnSO 4 + SO 2 + 2H 2 O;
สังกะสี + 4HNO 3 → สังกะสี(NO 3) 2 + 2NO 2 + 2H 2 O
ปฏิกิริยาระหว่างสังกะสีกับด่าง
ทำปฏิกิริยากับสารละลายอัลคาไลเพื่อสร้างสารเชิงซ้อนไฮดรอกโซ:
สังกะสี + 2NaOH + 2H 2 O → นา 2 + H 2
เมื่อหลอมรวมจะเกิดสังกะสี:
สังกะสี + 2KOH → K 2 ZnO 2 + H 2 .
ปฏิกิริยากับแอมโมเนีย
กับ ก๊าซแอมโมเนียที่อุณหภูมิ 550–600°C จะเกิดซิงค์ไนไตรด์:
3Zn + 2NH 3 → สังกะสี 3 N 2 + 3H 2;
ละลายในสารละลายแอมโมเนียในน้ำทำให้เกิดไฮดรอกไซด์สังกะสีเตตระแอมมิเนียม:
สังกะสี + 4NH 3 + 2H 2 O → (OH) 2 + H 2 .
ปฏิกิริยาระหว่างสังกะสีกับออกไซด์และเกลือ
สังกะสีจะแทนที่โลหะที่อยู่ในซีรีย์แรงดันไฟฟ้าทางด้านขวาของสารละลายเกลือและออกไซด์:
สังกะสี + CuSO 4 → Cu + ZnSO 4 ;
สังกะสี + CuO → Cu + ZnO
ซิงค์(II) ออกไซด์ ZnO
– ผลึกสีขาว เมื่อถูกความร้อนจะได้สีเหลือง ความหนาแน่น 5.7 g/cm3 อุณหภูมิระเหิด 1800°C ที่อุณหภูมิสูงกว่า 1,000°C คาร์บอน คาร์บอนมอนอกไซด์ และไฮโดรเจนจะลดลงเหลือสังกะสีโลหะ:
ZnO + C → Zn + CO;
ZnO + CO → Zn + CO 2;
ZnO + H 2 → Zn + H 2 O
ไม่โต้ตอบกับน้ำ แสดงคุณสมบัติของแอมโฟเทอริก ทำปฏิกิริยากับสารละลายกรดและด่าง:
ZnO + 2HCl → ZnCl 2 + H 2 O;
ZnO + 2NaOH + H 2 O → นา 2
เมื่อหลอมรวมกับออกไซด์ของโลหะจะเกิดสังกะสี:
ZnO + CoO → CoZnO 2
เมื่อทำปฏิกิริยากับออกไซด์ที่ไม่ใช่โลหะจะเกิดเกลือโดยที่มันคือแคตไอออน:
2ZnO + SiO 2 → สังกะสี 2 SiO 4,
ZnO + B 2 O 3 → Zn(BO 2) 2.
สังกะสี (II) ไฮดรอกไซด์ Zn(OH) 2
– ผลึกหรือสารอสัณฐานไม่มีสี ความหนาแน่น 3.05 g/cm3 สลายตัวที่อุณหภูมิสูงกว่า 125°C:
สังกะสี(OH) 2 → ZnO + H 2 O
ซิงค์ไฮดรอกไซด์มีคุณสมบัติเป็นแอมโฟเทอริกและสามารถละลายได้ง่ายในกรดและด่าง:
สังกะสี(OH) 2 + H 2 SO 4 → ZnSO 4 + 2H 2 O;
สังกะสี(OH) 2 + 2NaOH → นา 2;
ละลายได้ง่ายในสารละลายแอมโมเนียที่เป็นน้ำเพื่อสร้างไฮดรอกไซด์เตตระแอมมิเนียมซิงค์ไฮดรอกไซด์:
สังกะสี(OH) 2 + 4NH 3 → (OH) 2
ได้มาในรูปของตะกอนสีขาวเมื่อเกลือสังกะสีทำปฏิกิริยากับด่าง:
สังกะสี 2 + 2NaOH → สังกะสี(OH) 2 + 2NaCl
แคลเซียม + โซเดียมไนเตรต 3) กรดซัลฟูริก + แมกนีเซียมไฮดรอกไซด์ = แมกนีเซียมซัลเฟต + โฟดา 4) ลิเธียมออกไซด์ + กรดไฮโดรคลอริก = ลิเธียมคลอไรด์ + น้ำ 5) ซัลเฟอร์ออกไซด์ (V1) + โซเดียมไฮดรอกไซด์ = โซเดียมซัลเฟต + น้ำ 6) อลูมิเนียม + กรดไฮโดรโบรมิก = อะลูมิเนียมโบรไมด์ + ไฮโดรเจน 7) ตะกั่วไนเตรต (11) + โซเดียมซัลไฟด์ = ตะกั่วซัลไฟด์ (11) + กรดซิลิซิก 8) โพแทสเซียมซิลิเกต + กรดฟอสฟอริก = โพแทสเซียมฟอสเฟต + กรดซิลิซิก 9) กรดซิงค์ไฮดรอกไซด์-ไฮไดรโอดิก = ซิงค์ไอโอไดด์ + น้ำ 10) ไนตริกออกไซด์ (V) + โซเดียมไฮดรอกไซด์ = โพแทสเซียมไนเตรต + น้ำ 11) แบเรียมไนเตรต + กรดซัลฟูริก = แบเรียมซัลเฟต + กรดไนตริก 12) คาร์บอนมอนอกไซด์ (1V) - แคลเซียมไฮดรอกไซด์ = แคลเซียมคาร์บอเนต + น้ำ 13) ซัลเฟอร์ออกไซด์ (1V) + ออกไซด์ โพแทสเซียม = โพแทสเซียมซัลเฟต 14) แมกนีเซียมออกไซด์ + ฟอสฟอรัสออกไซด์ (V) = แมกนีเซียมฟอสเฟต 15) กรดไนตริก + โครเมียมไฮดรอกไซด์ (111) = โครเมียมไนเตรต (111) + น้ำ 16) กรดไฮโดรเจนซัลไฟด์ + ซิลเวอร์ไนเตรต = ซิลเวอร์ซัลไฟด์ + กรดไนตริก 17 ) เหล็กออกไซด์ (111) + ไฮโดรเจน = เหล็ก + น้ำ 18) คอปเปอร์ไนเตรต (11) + อลูมิเนียม = ทองแดง + อลูมิเนียมไนเตรต 19) อลูมิเนียมไฮดรอกไซด์ = อลูมิเนียมออกไซด์ + น้ำ
ก) โซเดียม --- โซเดียมไฮดรอกไซด์ --- โซเดียมซัลไฟด์ --- โซเดียมคลอไรด์ --- โซเดียมซัลเฟต b) แมกนีเซียม --- แมกนีเซียมซัลเฟต --- แมกนีเซียมไฮดรอกไซด์ --- แมกนีเซียมออกไซด์ --- แมกนีเซียมคลอไรด์c) ตะกั่ว - ตะกั่ว (II) ออกไซด์ - ตะกั่ว (II) ไนเตรต - ตะกั่ว (II) ไฮดรอกไซด์ - ตะกั่ว (II) ออกไซด์ - ตะกั่ว (II) ซัลเฟต d) ซัลเฟอร์ - ไฮโดรเจนซัลไฟด์ - โพแทสเซียมซัลไฟต์ - - โพแทสเซียมคลอไรด์ - โพแทสเซียมคลอไรด์ - กรดไฮโดรคลอริก e) แคลเซียม - แคลเซียมไฮดรอกไซด์ - แคลเซียมคาร์บอเนต - แคลเซียมไนเตรต - กรดไนตริก e) อลูมิเนียม - อลูมิเนียมซัลเฟต - อลูมิเนียมไฮดรอกไซด์ - อลูมิเนียมออกไซด์ - อลูมิเนียมไนเตรต g) ซัลเฟอร์ - ซัลเฟอร์ (IV) ออกไซด์ - กรดซัลฟูรัส - โซเดียมซัลไฟต์ - กรดซัลฟูรัส h) ออกซิเจน - อะลูมิเนียมออกไซด์ - อะลูมิเนียมซัลเฟต - อะลูมิเนียมไฮดรอกไซด์ - โซเดียมเมตาลูมิเนต j) อะลูมิเนียม - คลอไรด์ อะลูมิเนียม -- อะลูมิเนียมไนเตรต -- อะลูมิเนียมไฮดรอกไซด์ -- อะลูมิเนียมซัลเฟต l) ทองแดง -- ทองแดง (II) คลอไรด์ -- ทองแดง -- ทองแดง ( II) ออกไซด์ --ทองแดง (II) ไนเตรต ม)เหล็ก --เหล็ก (II) คลอไรด์ --เหล็ก(II) ไฮดรอกไซด์--เหล็ก(II) ซัลเฟต--เหล็ก n)เหล็ก--เหล็ก(III) คลอไรด์--เหล็ก (III) ไนเตรต - เหล็ก (III) ซัลเฟต - เหล็ก
1. ทำปฏิกิริยากับสารละลายในน้ำของโซเดียมคาร์บอเนต1) โพแทสเซียมซัลเฟต 3) คอปเปอร์ (II) ซัลไฟด์
2) คาร์บอนมอนอกไซด์ (IV) 4) กรดซิลิซิก
2. ทำปฏิกิริยากับสารละลายแบเรียมคลอไรด์
1) แคลเซียมไฮดรอกไซด์ 3) โซเดียมซัลเฟต
2) คอปเปอร์ (II) ไฮดรอกไซด์ 4) ไฮโดรเจน
3. ทำปฏิกิริยากับสารละลายแคลเซียมไนเตรต
1) โซเดียมคาร์บอเนต 3) ซิลิคอน
2) สังกะสี 4) กรดไฮโดรโบรมิก
4. เมื่อเกิดปฏิกิริยาระหว่าง 1 โมลกับ 2 โมล KoH เกิดขึ้น
1) เกลือปานกลาง 3) เกลือเปรี้ยว
2)เกลือพื้นฐาน 4)สารไม่ทำปฏิกิริยา
5. อันเป็นผลมาจากปฏิกิริยาของโซเดียมซิลิเกตกับกรดไฮโดรคลอริก
1) โซเดียมซิลิไซด์ 3) กรดซิลิซิก
2) ซิลิคอน 4) ซิลิคอนออกไซด์
1. เกลือและอัลคาไลเกิดขึ้นเมื่อสารละลายมีปฏิกิริยากัน
1)
2. ทำปฏิกิริยากับสารละลายแบเรียมไนเตรต
1) โซเดียมคลอไรด์ 3) โพแทสเซียมคาร์บอเนต
2) ทองแดง 4) แคลเซียมคาร์บอเนต
3. ทำปฏิกิริยากับสารละลายแบเรียมไนเตรต
1) โซเดียมซัลเฟต 3) เหล็ก
2) คำว่าคลอไรด์ 4) ทองแดง
4. ทำปฏิกิริยากับสารละลายซิงค์ซัลเฟต
1) แมกนีเซียม 3) กำมะถัน
2) ซิลิคอนออกไซด์ 4) อะลูมิเนียมไฮดรอกไซด์
5.ปฏิกิริยาเคมี(ในสารละลาย)เป็นไปได้ระหว่าง
6) ปฏิกิริยาเคมีเกิดขึ้นระหว่างสารใด?
1) แคลเซียมคาร์บอเนตและโซเดียมไนเตรต
2) แมกนีเซียมซิลิเกตและโพแทสเซียมฟอสเฟต
3) เหล็ก (II) ซัลเฟตและตะกั่วซัลไฟด์
4) แบเรียมคลอไรด์และซิงค์ซัลเฟต
ไอ.วี.ไตรกบจักร
ครูสอนเคมี
ความต่อเนื่อง ในเบื้องต้น ดูฉบับที่ 22/2548 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2549;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11/2008
บทที่ 24
ชั้นประถมศึกษาปีที่ 10(ปีแรกของการศึกษา)
สังกะสีและสารประกอบของมัน
1. ตำแหน่งในตารางของ D.I. Mendeleev โครงสร้างของอะตอม
2. ที่มาของชื่อ
3. คุณสมบัติทางกายภาพ
4. คุณสมบัติทางเคมี.
5. อยู่ในธรรมชาติ
6. วิธีการรับขั้นพื้นฐาน
7. ซิงค์ออกไซด์และไฮดรอกไซด์ - คุณสมบัติและวิธีการเตรียม
สังกะสีอยู่ในกลุ่มย่อยรองของกลุ่ม II ของตารางของ D.I. สูตรอิเล็กทรอนิกส์ของมันคือ 1 ส 2 2ส 2 พี 6 3ส 2 พี 6 ง 10 4ส 2. งสังกะสีนั่นเอง
![]()
-ธาตุ แสดงสถานะออกซิเดชันเดี่ยวที่ +2 ในสารประกอบ (เนื่องจากระดับพลังงานที่สามในอะตอมสังกะสีเต็มไปด้วยอิเล็กตรอนโดยสมบูรณ์) เนื่องจากเป็นองค์ประกอบแอมโฟเทอริกที่มีคุณสมบัติเป็นโลหะมากกว่า ในสารประกอบสังกะสีมักจะรวมอยู่ในองค์ประกอบของแคตไอออน ซึ่งมักจะอยู่ในแอนไอออนน้อยกว่า ตัวอย่างเช่น,
เชื่อกันว่าชื่อสังกะสีมาจากคำภาษาเยอรมันโบราณว่า “สังกะสี” (สีขาว, หนาม)
ในทางกลับกัน คำนี้กลับไปเป็นภาษาอาหรับ "harasin" (โลหะจากจีน) ซึ่งบ่งบอกถึงสถานที่ผลิตสังกะสีที่นำเข้าจากจีนไปยังยุโรปในยุคกลาง
โครงสร้างทางกายภาพ
สังกะสีเป็นโลหะสีขาว เมื่อสัมผัสกับอากาศ มันจะถูกปกคลุมไปด้วยฟิล์มออกไซด์ และพื้นผิวจะมัว ในสภาพอากาศเย็น สังกะสีจะเป็นโลหะที่ค่อนข้างเปราะ แต่ที่อุณหภูมิ 100–150 °C สังกะสีจะผ่านกระบวนการได้ง่ายและเกิดเป็นโลหะผสมกับโลหะอื่น ๆ
เรื่องราวทางเคมี
สังกะสีเป็นโลหะที่มีฤทธิ์ทางเคมีปานกลาง แต่มีฤทธิ์มากกว่าเหล็ก สังกะสีเมื่อฟิล์มออกไซด์ถูกทำลายจะมีคุณสมบัติทางเคมีดังนี้
สังกะสี + H 2 ZnH 2 .
2Zn + O 2 2ZnO
โลหะ (-)
อโลหะ (+):
สังกะสี + Cl 2 สังกะสี 2
3Zn + 2P สังกะสี 3 P 2 .
สังกะสี + 2H 2 O สังกะสี(OH) 2 + H 2 .
ออกไซด์พื้นฐาน (-)
ออกไซด์ของกรด (-)
Zn + 2NaOH (ละลาย) = นา 2 ZnO 2 + H 2
กรดที่ไม่ออกซิไดซ์ (+):
สังกะสี + 2HCl = สังกะสี 2 + H 2
กรดออกซิไดซ์ (+):
3Zn + 4H 2 SO 4 (สรุป) = 3ZnSO 4 + S + 4H 2 O
4Zn + 5H 2 SO 4 (สรุป) = 4ZnSO 4 + H 2 S + 4H 2 O,
4Zn + 10HNO 3 (พิเศษ dil.) = 4Zn(NO 3) 2 + NH 4 NO 3 + 3H 2 O.
เกลือ (+/–):*
สังกะสี + CuCl 2 = Cu + ZnCl 2
Zn + NaCl ไม่มีปฏิกิริยา
โดยธรรมชาติแล้ว สังกะสีพบอยู่ในรูปของสารประกอบ โดยสารประกอบที่สำคัญที่สุดคือ สฟาเลอไรต์ หรือสังกะสีผสม (ZnS) สมิธโซไนต์ หรือสังกะสีสปาร์ (ZnCO 3) แร่สังกะสีสีแดง (ZnO)
ในอุตสาหกรรม เพื่อให้ได้สังกะสี แร่สังกะสีจะถูกคั่วเพื่อผลิตซิงค์ออกไซด์ ซึ่งจะลดลงด้วยคาร์บอน:
2ZnS + 3O 2 2ZnO + 2SO 2,
2ZnO + C2Zn + CO 2 .
สารประกอบสังกะสีที่สำคัญที่สุด ได้แก่ ซิงค์ออกไซด์ (ZnO) และซิงค์ไฮดรอกไซด์ (Zn(OH) 2) เหล่านี้เป็นสารผลึกสีขาวที่มีคุณสมบัติเป็นแอมโฟเทอริก:
ZnO + H 2 SO 4 = ZnSO 4 + H 2 O,
ZnO + 2NaOH + H 2 O = นา 2
สังกะสี(OH) 2 + 2HCl = สังกะสี 2 + 2H 2 O,
สังกะสี(OH) 2 + 2NaOH = นา 2
ซิงค์ออกไซด์สามารถได้รับโดยการออกซิเดชันของสังกะสี การสลายตัวของซิงค์ไฮดรอกไซด์ หรือการคั่วส่วนผสมของสังกะสี:
สังกะสี(OH) 2 ZnO + H 2 O,
2ZnS + 3O 2 2ZnO + 3SO 2
ซิงค์ไฮดรอกไซด์ได้มาจากปฏิกิริยาการแลกเปลี่ยนระหว่างสารละลายเกลือสังกะสีและอัลคาไล:
ZnCl 2 + 2NaOH (ขาด) = Zn(OH) 2 + 2NaCl
ต้องจำสารประกอบเหล่านี้: ซิงค์ผสม (ZnS), ซิงค์ซัลเฟต (ZnSO 4 · 7H 2 O)
ทดสอบในหัวข้อ “สังกะสีและสารประกอบของมัน”
1. ผลรวมของค่าสัมประสิทธิ์ในสมการสำหรับปฏิกิริยาของสังกะสีกับกรดไนตริกเจือจางมาก:
ก) 20; ข) 22; ค) 24; ง) 29.
2. สังกะสีจากสารละลายเข้มข้นของโซเดียมคาร์บอเนตแทนที่:
ก) ไฮโดรเจน; b) คาร์บอนมอนอกไซด์
ค) คาร์บอนไดออกไซด์ ง) มีเทน
3. สารละลายอัลคาไลสามารถทำปฏิกิริยากับสารต่อไปนี้ได้ (มีหลายคำตอบที่ถูกต้อง):
ก) คอปเปอร์ซัลเฟตและคลอรีน
b) แคลเซียมออกไซด์และทองแดง
c) โซเดียมไฮโดรเจนซัลเฟตและสังกะสี
d) ซิงค์ไฮดรอกไซด์และคอปเปอร์ไฮดรอกไซด์
4. ความหนาแน่นของสารละลายโซเดียมไฮดรอกไซด์ 27.4% คือ 1.3 กรัมต่อมิลลิลิตร ความเข้มข้นโมลของอัลคาไลในสารละลายนี้คือ:
ก) 0.0089 โมล/มล.; ข) 0.0089 โมล/ลิตร;
ค) 4 โมล/ลิตร; ง) 8.905 โมล/ลิตร
5. ในการรับซิงค์ไฮดรอกไซด์คุณต้องมี:
ก) เติมสารละลายโซเดียมไฮดรอกไซด์ทีละหยดลงในสารละลายซิงค์คลอไรด์
b) เติมสารละลายซิงค์คลอไรด์ทีละหยดลงในสารละลายโซเดียมไฮดรอกไซด์
c) เพิ่มสารละลายโซเดียมไฮดรอกไซด์ส่วนเกินลงในสารละลายซิงค์คลอไรด์
d) เติมสารละลายโซเดียมไฮดรอกไซด์ทีละหยดลงในสารละลายซิงค์คาร์บอเนต
6. ขจัดการเชื่อมต่อที่ "ไม่จำเป็น":
ก) H 2 ZnO 2; b) สังกะสี 2; ค) สังกะสีโอ; ง) สังกะสี(OH) 2.
7. โลหะผสมของทองแดงและสังกะสีที่มีน้ำหนัก 24.12 กรัมได้รับการบำบัดด้วยกรดซัลฟิวริกเจือจางที่มากเกินไป ในกรณีนี้ปล่อยก๊าซ 3.36 ลิตร (n.s.) เศษส่วนมวลของสังกะสีในโลหะผสมนี้มีค่าเท่ากัน (เป็น%):
ก) 59.58; ข) 40.42; ค) 68.66; ง) 70.4
8. เม็ดสังกะสีจะทำปฏิกิริยากับสารละลายที่เป็นน้ำ (มีหลายคำตอบที่ถูกต้อง):
ก) กรดไฮโดรคลอริก b) กรดไนตริก;
c) โพแทสเซียมไฮดรอกไซด์; d) อลูมิเนียมซัลเฟต
9. คาร์บอนไดออกไซด์ที่มีปริมาตร 16.8 ลิตร (ns) ถูกดูดซับโดยสารละลายโพแทสเซียมไฮดรอกไซด์ 28% 400 กรัม
เศษส่วนมวลของสารในสารละลายคือ (เป็น%):
10. ก) 34.5; ข) 31.9; ค) 69; ง) 63.7
มวลของตัวอย่างซิงค์คาร์บอเนตที่มีอะตอมออกซิเจน 4.816 10 24 อะตอมคือ (เป็นกรัม):
ก) 1,000; ข) 33.3; ค) 100; ง) 333.3
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| กุญแจสำคัญในการทดสอบ | ข | ก | ก, ค | ข | กุญแจสำคัญในการทดสอบ | กุญแจสำคัญในการทดสอบ | ช | กุญแจสำคัญในการทดสอบ | ก, ค |
ก, ข, ค, ง
ปัญหาและแบบฝึกหัดเกี่ยวกับโลหะแอมโฟเทอริก
ห่วงโซ่แห่งการเปลี่ยนแปลง
2. 1. สังกะสี -> ซิงค์ออกไซด์ -> ซิงค์ไฮดรอกไซด์ -> ซิงค์ซัลเฟต -> ซิงค์คลอไรด์ -> ซิงค์ไนเตรต -> ซิงค์ซัลไฟด์ -> ซิงค์ออกไซด์ -> โพแทสเซียมซิซิเตต
3. อลูมิเนียมออกไซด์ -> โพแทสเซียม tetrahydroxoaluminate -> อลูมิเนียมคลอไรด์ -> อลูมิเนียมไฮดรอกไซด์ -> โพแทสเซียม tetrahydroxoaluminate
4. โซเดียม -> โซเดียมไฮดรอกไซด์ -> โซเดียมไบคาร์บอเนต -> โซเดียมคาร์บอเนต -> โซเดียมไฮดรอกไซด์ -> โซเดียมเฮกซะไฮดรอกโซโครเมต (III)
5. โครเมียม -> โครเมียม(II) คลอไรด์ -> โครเมียม(III) คลอไรด์ -> โพแทสเซียมเฮกซะไฮดรอกโซโครเมต (III) + โบรมีน + โพแทสเซียมไฮดรอกไซด์ -> โพแทสเซียมโครเมต -> โพแทสเซียมไดโครเมต -> โครเมียม (VI) ออกไซด์
6. เหล็ก (II) ซัลไฟด์ -> X 1 -> เหล็ก (III) ออกไซด์ -> X 2 -> เหล็ก (II) ซัลไฟด์
7. เหล็ก(II) คลอไรด์ -> A -> B -> C -> D -> D -> เหล็ก (II) คลอไรด์ (สารทั้งหมดประกอบด้วยธาตุเหล็ก มีปฏิกิริยารีดอกซ์เพียงสามปฏิกิริยาติดต่อกันในโครงการ)
โครเมียม -> X 1 -> โครเมียม (III) ซัลเฟต -> X 2 -> โพแทสเซียมไดโครเมต -> X 3 -> โครเมียม
1. ระดับเอ
ในการละลายโลหะผสมแมกนีเซียม-อลูมิเนียม 1.26 กรัม ให้ใช้สารละลายกรดซัลฟิวริก 19.6% 35 มล. (ความหนาแน่น 1.14 กรัม/มิลลิลิตร) กรดส่วนเกินทำปฏิกิริยากับสารละลายโพแทสเซียมไบคาร์บอเนต 28.6 มิลลิลิตร ที่ความเข้มข้น 1.4 โมล/ลิตรกำหนดองค์ประกอบของโลหะผสมเดิมและปริมาตรของก๊าซ (หมายเลข) ที่ปล่อยออกมาเมื่อโลหะผสมละลาย คำตอบ.
2. 57.6% มก.;
อัล 42.4%; 1.34 ลิตร H2.
ส่วนผสมของแคลเซียมและอลูมิเนียมน้ำหนัก 18.8 กรัมถูกเผาโดยไม่มีอากาศและมีผงกราไฟท์มากเกินไป ผลิตภัณฑ์ที่ทำปฏิกิริยาได้รับการบำบัดด้วยกรดไฮโดรคลอริกเจือจาง และก๊าซ 11.2 ลิตร (n.o.) ถูกปล่อยออกมา กำหนดองค์ประกอบของส่วนผสมเริ่มต้น

สารละลาย สมการปฏิกิริยา:ให้ (Ca) = xโมล (อัล) = 4
ย สมการปฏิกิริยา: + 4 27x = 18,8.
ตุ่น
จากนั้น: 40
ตามปัญหา:
(C 2 H 2 + CH 4) = 11.2/22.4 = 0.5 โมล
ตามสมการปฏิกิริยา:
(C 2 H 2) = (CaC 2) = (Ca) = เอ็กซ์ตุ่น,
(CH4) = 3/4 (อัล) = 3 xตุ่น,
สมการปฏิกิริยา: + 3x = 0,5.
เราแก้ไขระบบ:

สมการปฏิกิริยา: = 0,2, x = 0,1.
ตามปัญหา:
(Ca) = 0.2 โมล
(อัล) = 4 · 0.1 = 0.4 โมล
ในส่วนผสมดั้งเดิม:
ม(Ca) = 0.2 · 40 = 8 กรัม
(Ca) = 8/18.8 = 0.4255 หรือ 42.6%;
ม(อัล) = 0.4 27 = 10.8 กรัม
(อัล) = 10.8/18.8 = 0.5744 หรือ 57.4%
คำตอบ- แคลเซียม 42.6%; อัล 57.4%
3. เมื่อโลหะกลุ่ม VIII 11.2 กรัมในตารางธาตุทำปฏิกิริยากับคลอรีน จะเกิดคลอไรด์ 32.5 กรัม ระบุโลหะ
คำตอบ- เหล็ก.
4. เมื่อไพไรต์ถูกคั่ว จะปล่อยซัลเฟอร์ไดออกไซด์ 25 ลูกบาศก์เมตร (อุณหภูมิ 25 °C และความดัน 101 กิโลปาสคาล) คำนวณมวลของของแข็งที่เกิดขึ้น
ในการละลายโลหะผสมแมกนีเซียม-อลูมิเนียม 1.26 กรัม ให้ใช้สารละลายกรดซัลฟิวริก 19.6% 35 มล. (ความหนาแน่น 1.14 กรัม/มิลลิลิตร) กรดส่วนเกินทำปฏิกิริยากับสารละลายโพแทสเซียมไบคาร์บอเนต 28.6 มิลลิลิตร ที่ความเข้มข้น 1.4 โมล/ลิตร 40.8 กก. เฟ 2 โอ 3
5. เมื่อเผาผลึกไฮเดรตของธาตุเหล็ก (II) ซัลเฟต 69.5 กรัม จะเกิดเกลือปราศจากน้ำ 38 กรัม
ในการละลายโลหะผสมแมกนีเซียม-อลูมิเนียม 1.26 กรัม ให้ใช้สารละลายกรดซัลฟิวริก 19.6% 35 มล. (ความหนาแน่น 1.14 กรัม/มิลลิลิตร) กรดส่วนเกินทำปฏิกิริยากับสารละลายโพแทสเซียมไบคาร์บอเนต 28.6 มิลลิลิตร ที่ความเข้มข้น 1.4 โมล/ลิตรกำหนดสูตรของผลึกไฮเดรต
6. เฮปตะไฮเดรต FeSO 4 7H 2 O
ในการละลายโลหะผสมแมกนีเซียม-อลูมิเนียม 1.26 กรัม ให้ใช้สารละลายกรดซัลฟิวริก 19.6% 35 มล. (ความหนาแน่น 1.14 กรัม/มิลลิลิตร) กรดส่วนเกินทำปฏิกิริยากับสารละลายโพแทสเซียมไบคาร์บอเนต 28.6 มิลลิลิตร ที่ความเข้มข้น 1.4 โมล/ลิตรเมื่อสัมผัสกับกรดไฮโดรคลอริกส่วนเกินบนส่วนผสม 20 กรัมที่มีทองแดงและเหล็ก จะปล่อยก๊าซที่มีปริมาตร 3.36 ลิตร (n.s.) กำหนดองค์ประกอบของส่วนผสมเริ่มต้น
58% ลูกบาศก์เมตร; เฟอ 42%
1. ระดับบี
ในการละลายโลหะผสมแมกนีเซียม-อลูมิเนียม 1.26 กรัม ให้ใช้สารละลายกรดซัลฟิวริก 19.6% 35 มล. (ความหนาแน่น 1.14 กรัม/มิลลิลิตร) กรดส่วนเกินทำปฏิกิริยากับสารละลายโพแทสเซียมไบคาร์บอเนต 28.6 มิลลิลิตร ที่ความเข้มข้น 1.4 โมล/ลิตรควรเติมสารละลายโพแทสเซียมไฮดรอกไซด์ 40% (ความหนาแน่น 1.4 กรัม/มิลลิลิตร) ในปริมาณเท่าใดลงในอะลูมิเนียมคลอไรด์ 10% ของสารละลาย 50 กรัม เพื่อให้ตะกอนที่สะสมไว้ในตอนแรกละลายหมด
2. 15 มล.
โลหะถูกเผาในออกซิเจนเพื่อสร้างออกไซด์ 2.32 กรัม เพื่อลดความจำเป็นในการใช้คาร์บอนมอนอกไซด์ 0.896 ลิตร (n.s.) สำหรับโลหะ โลหะที่รีดิวซ์ถูกละลายในกรดซัลฟิวริกเจือจาง สารละลายที่ได้ทำให้เกิดตะกอนสีน้ำเงินพร้อมกับเกลือของเลือดแดงหาสูตรของออกไซด์.
3. คำตอบ:
ในการละลายโลหะผสมแมกนีเซียม-อลูมิเนียม 1.26 กรัม ให้ใช้สารละลายกรดซัลฟิวริก 19.6% 35 มล. (ความหนาแน่น 1.14 กรัม/มิลลิลิตร) กรดส่วนเกินทำปฏิกิริยากับสารละลายโพแทสเซียมไบคาร์บอเนต 28.6 มิลลิลิตร ที่ความเข้มข้น 1.4 โมล/ลิตรเฟ 3 โอ 4 .
4. สารละลายโพแทสเซียมไฮดรอกไซด์ 5.6 โมลาร์จะต้องใช้ปริมาตรเท่าใดในการละลายส่วนผสมของโครเมียม (III) และอะลูมิเนียมไฮดรอกไซด์ 5 กรัม โดยสมบูรณ์ หากสัดส่วนมวลของออกซิเจนในส่วนผสมนี้คือ 50%
ในการละลายโลหะผสมแมกนีเซียม-อลูมิเนียม 1.26 กรัม ให้ใช้สารละลายกรดซัลฟิวริก 19.6% 35 มล. (ความหนาแน่น 1.14 กรัม/มิลลิลิตร) กรดส่วนเกินทำปฏิกิริยากับสารละลายโพแทสเซียมไบคาร์บอเนต 28.6 มิลลิลิตร ที่ความเข้มข้น 1.4 โมล/ลิตร 9.3 มล.
5. เติมโซเดียมซัลไฟด์ลงในสารละลายโครเมียม (III) ไนเตรต 14% ผลลัพธ์ที่ได้จะถูกกรองและต้ม (โดยไม่สูญเสียน้ำ) และสัดส่วนมวลของเกลือโครเมียมลดลงเหลือ 10% หาเศษส่วนมวลของสารที่เหลืออยู่ในสารละลายที่ได้
ในการละลายโลหะผสมแมกนีเซียม-อลูมิเนียม 1.26 กรัม ให้ใช้สารละลายกรดซัลฟิวริก 19.6% 35 มล. (ความหนาแน่น 1.14 กรัม/มิลลิลิตร) กรดส่วนเกินทำปฏิกิริยากับสารละลายโพแทสเซียมไบคาร์บอเนต 28.6 มิลลิลิตร ที่ความเข้มข้น 1.4 โมล/ลิตรนาโน38% 4.38%
6. เหล็กซัลเฟต 139 กรัมละลายในน้ำที่อุณหภูมิ 20 °C เพื่อให้ได้สารละลายอิ่มตัว เมื่อสารละลายนี้ถูกทำให้เย็นลงถึง 10 °C จะเกิดการตกตะกอนของเหล็กซัลเฟต ค้นหามวลของตะกอนและเศษส่วนมวลของธาตุเหล็ก (II) ซัลเฟตในสารละลายที่เหลือ (ความสามารถในการละลายของธาตุเหล็ก (II) ซัลเฟตที่ 20 °C คือ 26 กรัม และที่ 10 °C - 20 กรัม)
ในการละลายโลหะผสมแมกนีเซียม-อลูมิเนียม 1.26 กรัม ให้ใช้สารละลายกรดซัลฟิวริก 19.6% 35 มล. (ความหนาแน่น 1.14 กรัม/มิลลิลิตร) กรดส่วนเกินทำปฏิกิริยากับสารละลายโพแทสเซียมไบคาร์บอเนต 28.6 มิลลิลิตร ที่ความเข้มข้น 1.4 โมล/ลิตร 38.45 กรัม FeSO 4 · 7H 2 O; 16.67%.
งานเชิงคุณภาพ
1. สารเชิงเดี่ยวแสงสีขาวเงิน A ซึ่งมีค่าการนำความร้อนและไฟฟ้าที่ดี จะทำปฏิกิริยาเมื่อถูกความร้อนกับสารเชิงเดี่ยว B อีกชนิดหนึ่ง ส่งผลให้ของแข็งละลายในกรดและปล่อยก๊าซ C ซึ่งเมื่อผ่านสารละลายกรดซัลฟิวรัส ตกตะกอนสาร B ระบุสาร เขียนสมการปฏิกิริยา
ในการละลายโลหะผสมแมกนีเซียม-อลูมิเนียม 1.26 กรัม ให้ใช้สารละลายกรดซัลฟิวริก 19.6% 35 มล. (ความหนาแน่น 1.14 กรัม/มิลลิลิตร) กรดส่วนเกินทำปฏิกิริยากับสารละลายโพแทสเซียมไบคาร์บอเนต 28.6 มิลลิลิตร ที่ความเข้มข้น 1.4 โมล/ลิตรสาร: A – อัล, B – S, C – H 2 S.
2. มีก๊าซอยู่ 2 ชนิดคือ A และ B ซึ่งมีโมเลกุลเป็นไตรอะตอม เมื่อเติมแต่ละอย่างลงในสารละลายโพแทสเซียมอะลูมิเนตจะเกิดการตกตะกอน
อัล 42.4%; 1.34 ลิตร H2.
เสนอสูตรที่เป็นไปได้สำหรับก๊าซ A และ B โดยคำนึงว่าก๊าซเหล่านี้เป็นก๊าซไบนารี่ เขียนสมการปฏิกิริยา ก๊าซเหล่านี้สามารถแยกแยะความแตกต่างทางเคมีได้อย่างไร?
แก๊ส A – CO 2; แก๊ส B – H 2 ส.
2KAlO 2 + CO 2 + 3H 2 O = 2Al(OH) 3 + K 2 CO 3,
3. 2KAlO 2 + H 2 S + 2H 2 O = 2Al(OH) 3 + K 2 S
ในการละลายโลหะผสมแมกนีเซียม-อลูมิเนียม 1.26 กรัม ให้ใช้สารละลายกรดซัลฟิวริก 19.6% 35 มล. (ความหนาแน่น 1.14 กรัม/มิลลิลิตร) กรดส่วนเกินทำปฏิกิริยากับสารละลายโพแทสเซียมไบคาร์บอเนต 28.6 มิลลิลิตร ที่ความเข้มข้น 1.4 โมล/ลิตรสารประกอบ A สีน้ำตาล ซึ่งไม่ละลายในน้ำ จะสลายตัวเมื่อถูกความร้อนจนเกิดเป็นออกไซด์ 2 ชนิด หนึ่งในนั้นคือน้ำ ออกไซด์อีกชนิดหนึ่งคือ B จะถูกรีดิวซ์ด้วยคาร์บอนเพื่อสร้างโลหะ C ซึ่งเป็นโลหะที่มีมากเป็นอันดับสองในธรรมชาติ
ระบุสาร เขียนสมการปฏิกิริยา
4. สาร: เอ – เฟ(OH) 3,
ในการละลายโลหะผสมแมกนีเซียม-อลูมิเนียม 1.26 กรัม ให้ใช้สารละลายกรดซัลฟิวริก 19.6% 35 มล. (ความหนาแน่น 1.14 กรัม/มิลลิลิตร) กรดส่วนเกินทำปฏิกิริยากับสารละลายโพแทสเซียมไบคาร์บอเนต 28.6 มิลลิลิตร ที่ความเข้มข้น 1.4 โมล/ลิตร B – เฟ 2 O 3, C – เฟ
เกลือ A เกิดจากธาตุ 2 ชนิด เมื่อนำไปคั่วในอากาศ จะเกิดออกไซด์ 2 ชนิด คือ B ได้แก่ ของแข็ง สีน้ำตาล และก๊าซ ออกไซด์ B เกิดปฏิกิริยาทดแทนกับโลหะสีเงินขาว C (เมื่อถูกความร้อน) ระบุสาร เขียนสมการปฏิกิริยา
สาร: A – FeS 2, B – Fe 2 O 3, C – Al
ทองแดง (Cu) อยู่ในองค์ประกอบ d และอยู่ในกลุ่ม IB ของตารางธาตุของ D.I. การกำหนดค่าทางอิเล็กทรอนิกส์ของอะตอมทองแดงในสถานะพื้นเขียนเป็น 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 แทนสูตรที่คาดไว้ 1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2 กล่าวอีกนัยหนึ่ง ในกรณีของอะตอมทองแดง จะสังเกตเห็นสิ่งที่เรียกว่า "การกระโดดของอิเล็กตรอน" จากระดับย่อย 4s ไปยังระดับย่อย 3d สำหรับทองแดง นอกเหนือจากศูนย์แล้ว สถานะออกซิเดชัน +1 และ +2 ก็เป็นไปได้ สถานะออกซิเดชัน +1 มีแนวโน้มที่จะไม่สมส่วนและมีความเสถียรเฉพาะในสารประกอบที่ไม่ละลายน้ำ เช่น CuI, CuCl, Cu 2 O เป็นต้น รวมถึงในสารประกอบเชิงซ้อน เช่น Cl และ OH สารประกอบทองแดงในสถานะออกซิเดชัน +1 จะไม่มีสีเฉพาะเจาะจง ดังนั้น คอปเปอร์ (I) ออกไซด์อาจเป็นสีแดงเข้ม (ผลึกขนาดใหญ่) และสีเหลือง (ผลึกเล็ก) ทั้งนี้ขึ้นอยู่กับขนาดของผลึก CuCl และ CuI เป็นสีขาว และ Cu 2 S เป็นสีดำและสีน้ำเงิน สถานะออกซิเดชันของทองแดงเท่ากับ +2 มีความเสถียรทางเคมีมากกว่า เกลือที่มีทองแดงในสถานะออกซิเดชันนี้จะมีสีฟ้าและเขียวอมฟ้า
ทองแดงเป็นโลหะที่อ่อนนุ่ม อ่อนตัวได้ และเหนียว โดยมีค่าการนำไฟฟ้าและความร้อนสูง สีของทองแดงเมทัลลิกคือแดง-ชมพู ทองแดงอยู่ในชุดกิจกรรมของโลหะทางด้านขวาของไฮโดรเจน เช่น เป็นของโลหะที่มีฤทธิ์ต่ำ
ด้วยออกซิเจน
ภายใต้สภาวะปกติ ทองแดงจะไม่ทำปฏิกิริยากับออกซิเจน ต้องใช้ความร้อนเพื่อให้เกิดปฏิกิริยาระหว่างกัน ขึ้นอยู่กับส่วนเกินหรือการขาดออกซิเจนและสภาวะอุณหภูมิ คอปเปอร์ (II) ออกไซด์และคอปเปอร์ (I) ออกไซด์สามารถก่อตัว:
ด้วยกำมะถัน
ปฏิกิริยาของซัลเฟอร์กับทองแดงขึ้นอยู่กับเงื่อนไขสามารถนำไปสู่การก่อตัวของทั้งคอปเปอร์ (I) ซัลไฟด์และคอปเปอร์ (II) ซัลไฟด์ เมื่อส่วนผสมของผง Cu และ S ถูกให้ความร้อนที่อุณหภูมิ 300-400 o C จะเกิดคอปเปอร์ (I) ซัลไฟด์:
หากมีการขาดซัลเฟอร์และทำปฏิกิริยาที่อุณหภูมิสูงกว่า 400 o C จะเกิดคอปเปอร์ (II) ซัลไฟด์ อย่างไรก็ตามเพิ่มเติม ด้วยวิธีง่ายๆการได้รับคอปเปอร์ซัลไฟด์ (II) จากสารธรรมดาคือปฏิกิริยาของทองแดงกับซัลเฟอร์ที่ละลายในคาร์บอนไดซัลไฟด์:
ปฏิกิริยานี้เกิดขึ้นที่ อุณหภูมิห้อง.
ด้วยฮาโลเจน
ทองแดงทำปฏิกิริยากับฟลูออรีน คลอรีน และโบรมีน เกิดเป็นเฮไลด์ด้วยสูตรทั่วไป CuHal 2 โดยที่ Hal คือ F, Cl หรือ Br:
Cu + Br 2 = CuBr 2
ในกรณีของไอโอดีน สารออกซิไดซ์ที่อ่อนแอที่สุดในบรรดาฮาโลเจน ไอโอไดด์ของทองแดง (I) จะเกิดขึ้น:
ทองแดงไม่มีปฏิกิริยากับไฮโดรเจน ไนโตรเจน คาร์บอน และซิลิคอน
ด้วยกรดที่ไม่ออกซิไดซ์
กรดเกือบทั้งหมดเป็นกรดที่ไม่ออกซิไดซ์ ยกเว้นกรดซัลฟิวริกเข้มข้นและกรดไนตริกที่มีความเข้มข้นเท่าใดก็ได้ เนื่องจากกรดที่ไม่ออกซิไดซ์สามารถออกซิไดซ์ได้เฉพาะโลหะในชุดกิจกรรมจนถึงไฮโดรเจน ซึ่งหมายความว่าทองแดงไม่ทำปฏิกิริยากับกรดดังกล่าว
ด้วยกรดออกซิไดซ์
- กรดซัลฟิวริกเข้มข้น
ทองแดงทำปฏิกิริยากับกรดซัลฟิวริกเข้มข้นทั้งเมื่อถูกความร้อนและที่อุณหภูมิห้อง เมื่อถูกความร้อน ปฏิกิริยาจะเกิดขึ้นตามสมการ:
เนื่องจากทองแดงไม่ใช่ตัวรีดิวซ์ที่แรง ซัลเฟอร์จึงถูกรีดิวซ์ในปฏิกิริยานี้เหลือเพียงสถานะออกซิเดชัน +4 (ใน SO 2)
- ด้วยกรดไนตริกเจือจาง
ปฏิกิริยาของทองแดงกับ HNO 3 เจือจางทำให้เกิดการก่อตัวของไนเตรตทองแดง (II) และไนโตรเจนมอนนอกไซด์:
3Cu + 8HNO 3 (เจือจาง) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
- ด้วยกรดไนตริกเข้มข้น
HNO 3 ที่มีความเข้มข้นจะทำปฏิกิริยากับทองแดงได้ง่ายภายใต้สภาวะปกติ ความแตกต่างระหว่างปฏิกิริยาของทองแดงกับกรดไนตริกเข้มข้นและปฏิกิริยากับกรดไนตริกเจือจางอยู่ที่ผลคูณของการลดไนโตรเจน ในกรณีของ HNO 3 เข้มข้น ไนโตรเจนจะลดลงในระดับที่น้อยกว่า: แทนที่จะเป็นไนตริกออกไซด์ (II) จะเกิดไนตริกออกไซด์ (IV) ซึ่งเกิดจากการแข่งขันที่มากขึ้นระหว่างโมเลกุลของกรดไนตริกในกรดเข้มข้นสำหรับอิเล็กตรอนของการรีดิวซ์ ตัวแทน (Cu):
Cu + 4HNO 3 = Cu(NO 3) 2 + 2NO 2 + 2H 2 O
ด้วยออกไซด์ที่ไม่ใช่โลหะ
ทองแดงทำปฏิกิริยากับออกไซด์ที่ไม่ใช่โลหะบางชนิด ตัวอย่างเช่นด้วยออกไซด์เช่น NO 2, NO, N 2 O ทองแดงจะถูกออกซิไดซ์เป็นทองแดง (II) ออกไซด์และไนโตรเจนจะลดลงสู่สถานะออกซิเดชัน 0 เช่น เกิดสารอย่างง่าย N 2:
ในกรณีของซัลเฟอร์ไดออกไซด์ คอปเปอร์(I) ซัลไฟด์จะเกิดขึ้นแทนสารอย่างง่าย (ซัลเฟอร์) นี่เป็นเพราะความจริงที่ว่าทองแดงและซัลเฟอร์ทำปฏิกิริยาไม่เหมือนกับไนโตรเจน:
ด้วยออกไซด์ของโลหะ
เมื่อเผาทองแดงโลหะด้วยคอปเปอร์ (II) ออกไซด์ที่อุณหภูมิ 1,000-2,000 o C สามารถรับทองแดง (I) ออกไซด์ได้:
นอกจากนี้ ทองแดงที่เป็นโลหะยังสามารถลดเหล็ก (III) ออกไซด์เป็นเหล็ก (II) ออกไซด์ได้เมื่อเผา:
ด้วยเกลือของโลหะ
ทองแดงจะแทนที่โลหะที่มีฤทธิ์น้อยกว่า (ทางด้านขวาของชุดกิจกรรม) จากสารละลายเกลือ:
Cu + 2AgNO 3 = Cu(NO 3) 2 + 2Ag↓
ปฏิกิริยาที่น่าสนใจยังเกิดขึ้นโดยที่ทองแดงละลายในเกลือของโลหะที่มีฤทธิ์มากกว่า - เหล็กในสถานะออกซิเดชัน +3 อย่างไรก็ตามไม่มีความขัดแย้งเพราะว่า ทองแดงไม่ได้แทนที่เหล็กจากเกลือ แต่จะลดจากสถานะออกซิเดชัน +3 เป็นสถานะออกซิเดชัน +2 เท่านั้น:
เฟ 2 (SO 4) 3 + Cu = CuSO 4 + 2FeSO 4
Cu + 2FeCl 3 = CuCl 2 + 2FeCl 2
ปฏิกิริยาหลังใช้ในการผลิตไมโครวงจรในขั้นตอนการแกะสลักแผงวงจรทองแดง
การกัดกร่อนของทองแดง
ทองแดงจะสึกกร่อนเมื่อเวลาผ่านไปเมื่อสัมผัสกับความชื้น คาร์บอนไดออกไซด์ และออกซิเจนในบรรยากาศ:
2Cu + H 2 O + CO 2 + O 2 = (CuOH) 2 CO 3
จากปฏิกิริยานี้ ผลิตภัณฑ์ทองแดงถูกเคลือบด้วยไฮดรอกซีคาร์บอเนตทองแดง (II) เคลือบสีน้ำเงินเขียวแบบหลวมๆ
คุณสมบัติทางเคมีของสังกะสี
Zinc Zn อยู่ในกลุ่ม IIB ของช่วง IV การกำหนดค่าทางอิเล็กทรอนิกส์ของเวเลนซ์ออร์บิทัลของอะตอมขององค์ประกอบทางเคมีในสถานะพื้นคือ 3d 10 4s 2 สำหรับสังกะสี จะมีสถานะออกซิเดชันได้เพียงสถานะเดียวเท่านั้น ซึ่งเท่ากับ +2 ซิงค์ออกไซด์ ZnO และซิงค์ไฮดรอกไซด์ Zn(OH) 2 มีคุณสมบัติแอมโฟเทอริกเด่นชัด
สังกะสีจะหมองเมื่อเก็บไว้ในอากาศ และถูกเคลือบด้วย ZnO ออกไซด์บางๆ ออกซิเดชันเกิดขึ้นได้ง่ายเป็นพิเศษเมื่อมีความชื้นสูงและในที่ที่มีคาร์บอนไดออกไซด์เนื่องจากปฏิกิริยา:
2Zn + H 2 O + O 2 + CO 2 → สังกะสี 2 (OH) 2 CO 3
ไอสังกะสีเผาไหม้ในอากาศ และแถบสังกะสีบาง ๆ หลังจากถูกเผาไหม้ในเปลวไฟจากตะเกียง ก็เผาไหม้ด้วยเปลวไฟสีเขียว:
เมื่อถูกความร้อน สังกะสีโลหะยังทำปฏิกิริยากับฮาโลเจน ซัลเฟอร์ และฟอสฟอรัส:
สังกะสีไม่ทำปฏิกิริยาโดยตรงกับไฮโดรเจน ไนโตรเจน คาร์บอน ซิลิคอน และโบรอน
สังกะสีทำปฏิกิริยากับกรดที่ไม่ออกซิไดซ์เพื่อปล่อยไฮโดรเจน:
สังกะสี + H 2 SO 4 (20%) → ZnSO 4 + H 2
สังกะสี + 2HCl → ZnCl 2 + H 2
สังกะสีทางเทคนิคละลายได้ง่ายในกรด เนื่องจากมีโลหะเจือปนอื่นๆ ที่มีฤทธิ์น้อย โดยเฉพาะแคดเมียมและทองแดง สังกะสีที่มีความบริสุทธิ์สูงสามารถทนต่อกรดได้ด้วยเหตุผลบางประการ เพื่อเร่งปฏิกิริยา ให้นำตัวอย่างสังกะสีที่มีความบริสุทธิ์สูงมาสัมผัสกับทองแดงหรือเติมเกลือทองแดงเล็กน้อยลงในสารละลายกรด
ที่อุณหภูมิ 800-900 o C (ความร้อนสีแดง) โลหะสังกะสีซึ่งอยู่ในสถานะหลอมเหลวจะทำปฏิกิริยากับไอน้ำร้อนยวดยิ่งปล่อยไฮโดรเจนออกมา:
สังกะสี + H 2 O = ZnO + H 2
สังกะสียังทำปฏิกิริยากับกรดออกซิไดซ์: ซัลฟิวริกเข้มข้นและไนตริก
สังกะสีในฐานะโลหะที่ออกฤทธิ์สามารถเกิดซัลเฟอร์ไดออกไซด์ ธาตุซัลเฟอร์ และแม้แต่ไฮโดรเจนซัลไฟด์ด้วยกรดซัลฟิวริกเข้มข้น
สังกะสี + 2H 2 SO 4 = สังกะสี SO 4 + SO 2 + 2H 2 O
องค์ประกอบของผลิตภัณฑ์รีดิวซ์ของกรดไนตริกถูกกำหนดโดยความเข้มข้นของสารละลาย:
สังกะสี + 4HNO 3 (สรุป) = สังกะสี(NO 3) 2 + 2NO 2 + 2H 2 O
3Zn + 8HNO 3 (40%) = 3Zn(NO 3) 2 + 2NO + 4H 2 O
4Zn +10HNO 3 (20%) = 4Zn(NO 3) 2 + N 2 O + 5H 2 O
5Zn + 12HNO 3 (6%) = 5Zn(NO 3) 2 + N 2 + 6H 2 O
4Zn + 10HNO3 (0.5%) = 4Zn(NO3)2 + NH4NO3 + 3H2O
ทิศทางของกระบวนการยังได้รับอิทธิพลจากอุณหภูมิ ปริมาณกรด ความบริสุทธิ์ของโลหะ และเวลาปฏิกิริยาอีกด้วย
สังกะสีทำปฏิกิริยากับสารละลายอัลคาไลเพื่อก่อตัว เตตระไฮดรอกซีซิเนตและไฮโดรเจน:
สังกะสี + 2NaOH + 2H 2 O = นา 2 + H 2
สังกะสี + Ba(OH) 2 + 2H 2 O = Ba + H 2
เมื่อผสมกับด่างไร้น้ำจะเกิดสังกะสีขึ้น สังกะสีและไฮโดรเจน:
ในสภาพแวดล้อมที่มีความเป็นด่างสูง สังกะสีเป็นตัวรีดิวซ์ที่แข็งแกร่งมาก ซึ่งสามารถลดไนโตรเจนในไนเตรตและไนไตรต์เป็นแอมโมเนียได้:
4Zn + นาNO 3 + 7NaOH + 6H 2 O → 4Na 2 + NH 3
เนื่องจากความซับซ้อน สังกะสีจะละลายอย่างช้าๆ ในสารละลายแอมโมเนีย ส่งผลให้ไฮโดรเจนลดลง:
สังกะสี + 4NH 3 H 2 O → (OH) 2 + H 2 + 2H 2 O
สังกะสียังช่วยลดโลหะที่มีฤทธิ์น้อย (ทางด้านขวาของชุดกิจกรรม) จากสารละลายที่เป็นน้ำของเกลือ:
สังกะสี + CuCl 2 = Cu + ZnCl 2
สังกะสี + FeSO 4 = เฟ + ZnSO 4
คุณสมบัติทางเคมีของโครเมียม
โครเมียมเป็นองค์ประกอบของกลุ่ม VIB ของตารางธาตุ การกำหนดค่าทางอิเล็กทรอนิกส์ของอะตอมโครเมียมเขียนเป็น 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 เช่น ในกรณีของโครเมียมรวมทั้งในกรณีของอะตอมของทองแดงจะเรียกว่า "การรั่วไหลของอิเล็กตรอน"
สถานะออกซิเดชันที่แสดงโดยทั่วไปของโครเมียมคือ +2, +3 และ +6 ควรจดจำไว้และภายในกรอบของโปรแกรม Unified State Examination ในวิชาเคมี ก็สามารถสันนิษฐานได้ว่าโครเมียมไม่มีสถานะออกซิเดชันอื่น ๆ
ภายใต้สภาวะปกติ โครเมียมสามารถทนต่อการกัดกร่อนทั้งในอากาศและน้ำ
ปฏิกิริยากับอโลหะ
ด้วยออกซิเจน
เมื่อให้ความร้อนที่อุณหภูมิมากกว่า 600 o C โลหะโครเมียมที่เป็นผงจะเผาไหม้ในออกซิเจนบริสุทธิ์ที่ก่อตัวเป็นโครเมียม (III) ออกไซด์:
4Cr + 3O2 = โอ ที=> 2Cr 2 O 3
ด้วยฮาโลเจน
โครเมียมทำปฏิกิริยากับคลอรีนและฟลูออรีนที่อุณหภูมิต่ำกว่าออกซิเจน (250 และ 300 o C ตามลำดับ):
2Cr + 3F 2 = โอ ที=> 2CrF 3
2Cr + 3Cl2 = โอ ที=> 2CrCl 3
โครเมียมทำปฏิกิริยากับโบรมีนที่อุณหภูมิร้อนแดง (850-900 o C):
2Cr + 3Br 2 = โอ ที=> 2CrBr3
ด้วยไนโตรเจน
โครเมียมโลหะทำปฏิกิริยากับไนโตรเจนที่อุณหภูมิสูงกว่า 1,000 o C:
2Cr + N 2 = โอที=> 2CrN
ด้วยกำมะถัน
ด้วยซัลเฟอร์ โครเมียมสามารถสร้างทั้งโครเมียม (II) ซัลไฟด์และโครเมียม (III) ซัลไฟด์ ซึ่งขึ้นอยู่กับสัดส่วนของซัลเฟอร์และโครเมียม:
Cr+S= หรือ=>CrS
2Cr + 3S = หรือ=> Cr 2 ส 3
โครเมียมไม่ทำปฏิกิริยากับไฮโดรเจน
ปฏิกิริยากับสารที่ซับซ้อน
ปฏิสัมพันธ์กับน้ำ
โครเมียมเป็นโลหะที่มีฤทธิ์ปานกลาง (อยู่ในชุดกิจกรรมของโลหะระหว่างอะลูมิเนียมและไฮโดรเจน) ซึ่งหมายความว่าปฏิกิริยาเกิดขึ้นระหว่างโครเมียมร้อนแดงกับไอน้ำร้อนยวดยิ่ง:
2Cr + 3H2O = หรือ=> Cr 2 O 3 + 3H 2
ปฏิกิริยากับกรด
โครเมียมภายใต้สภาวะปกติจะถูกทำให้ผ่านโดยกรดซัลฟิวริกและกรดไนตริกเข้มข้นอย่างไรก็ตามมันจะละลายในพวกมันเมื่อเดือดในขณะที่ออกซิไดซ์ไปสู่สถานะออกซิเดชัน +3:
Cr + 6HNO 3(กระชับ) = ถึง=> Cr(NO 3) 3 + 3NO 2 + 3H 2 O
2Cr + 6H 2 SO 4(คอนซี) = ถึง=> Cr 2 (SO 4) 3 + 3SO 2 + 6H 2 O
ในกรณีของกรดไนตริกเจือจาง ผลิตภัณฑ์หลักของการลดไนโตรเจนคือสารอย่างง่าย N 2:
10Cr + 36HNO 3(ดิล) = 10Cr(NO 3) 3 + 3N 2 + 18H 2 O
โครเมียมอยู่ในชุดกิจกรรมทางด้านซ้ายของไฮโดรเจน ซึ่งหมายความว่าสามารถปล่อย H2 ออกจากสารละลายของกรดที่ไม่ออกซิไดซ์ได้ ในระหว่างปฏิกิริยาดังกล่าว เกลือโครเมียม (II) จะเกิดขึ้นในกรณีที่ไม่สามารถเข้าถึงออกซิเจนในบรรยากาศได้:
Cr + 2HCl = CrCl 2 + H 2
Cr + H 2 SO 4 (เจือจาง) = CrSO 4 + H 2
เมื่อทำปฏิกิริยาในที่โล่ง โครเมียมไดวาเลนต์จะถูกออกซิไดซ์ทันทีโดยออกซิเจนที่มีอยู่ในอากาศจนมีสถานะออกซิเดชัน +3 ตัวอย่างเช่น ในกรณีนี้ สมการของกรดไฮโดรคลอริกจะอยู่ในรูปแบบ:
4Cr + 12HCl + 3O 2 = 4CrCl 3 + 6H 2 O
เมื่อโครเมียมโลหะถูกหลอมรวมกับสารออกซิไดซ์ที่แรงโดยมีอัลคาลิสอยู่ โครเมียมจะถูกออกซิไดซ์เป็นสถานะออกซิเดชัน +6 ซึ่งก่อตัวขึ้น โครเมต:
คุณสมบัติทางเคมีของเหล็ก
เหล็ก Fe เป็นองค์ประกอบทางเคมีที่อยู่ในกลุ่ม VIIIB และมีเลขลำดับ 26 ในตารางธาตุ การกระจายตัวของอิเล็กตรอนในอะตอมเหล็กมีดังนี้ 26 Fe1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 นั่นคือเหล็กเป็นขององค์ประกอบ d เนื่องจากระดับย่อย d ถูกเติมเต็มในกรณีของมัน มีลักษณะเฉพาะมากที่สุดด้วยสถานะออกซิเดชันสองสถานะคือ +2 และ +3 FeO ออกไซด์และ Fe(OH) 2 ไฮดรอกไซด์มีคุณสมบัติพื้นฐานเด่น ในขณะที่ Fe 2 O 3 ออกไซด์และ Fe(OH) 3 ไฮดรอกไซด์มีคุณสมบัติแอมโฟเทอริกอย่างเห็นได้ชัด ดังนั้นเหล็กออกไซด์และไฮดรอกไซด์ (lll) จะละลายได้ในระดับหนึ่งเมื่อต้มในสารละลายอัลคาไลเข้มข้นและยังทำปฏิกิริยากับอัลคาไลปราศจากน้ำในระหว่างการฟิวชั่น ควรสังเกตว่าสถานะออกซิเดชันของเหล็ก +2 นั้นไม่เสถียรมากและผ่านเข้าสู่สถานะออกซิเดชัน +3 ได้อย่างง่ายดาย เรียกอีกอย่างว่าสารประกอบเหล็กในสถานะออกซิเดชันที่หายาก +6 - เฟอร์เรต, เกลือของ "กรดเหล็ก" ที่ไม่มีอยู่จริง H 2 FeO 4 สารประกอบเหล่านี้ค่อนข้างเสถียรเฉพาะในสถานะของแข็งหรือในสารละลายที่มีความเป็นด่างสูงเท่านั้น หากความเป็นด่างของสิ่งแวดล้อมไม่เพียงพอ เฟอร์เรตจะออกซิไดซ์อย่างรวดเร็วแม้กระทั่งน้ำ และปล่อยออกซิเจนออกมา
ปฏิกิริยากับสารธรรมดา
ด้วยออกซิเจน
เมื่อเผาด้วยออกซิเจนบริสุทธิ์ เหล็กจะเกิดสิ่งที่เรียกว่า เหล็ก มาตราส่วนมีสูตร Fe 3 O 4 และเป็นตัวแทนของออกไซด์ผสมจริง ๆ ซึ่งองค์ประกอบนี้สามารถแสดงตามอัตภาพด้วยสูตร FeO∙Fe 2 O 3 ปฏิกิริยาการเผาไหม้ของเหล็กมีรูปแบบดังนี้
3เฟ + 2O 2 = ถึง=> เฟ 3 O 4
ด้วยกำมะถัน
เมื่อถูกความร้อน เหล็กจะทำปฏิกิริยากับซัลเฟอร์และเกิดเป็นเฟอร์รัสซัลไฟด์:
เฟ + ส = ถึง=>เฟส
หรือมีกำมะถันส่วนเกิน เหล็กซัลไฟด์:
เฟ + 2S = ถึง=>เฟส 2
ด้วยฮาโลเจน
เหล็กที่เป็นโลหะจะถูกออกซิไดซ์โดยฮาโลเจนทั้งหมด ยกเว้นไอโอดีน จนถึงสถานะออกซิเดชัน +3 ทำให้เกิดเป็นเหล็กเฮไลด์ (lll):
2เฟ + 3F 2 = ถึง=> 2FeF 3 – เหล็กฟลูออไรด์ (lll)
2เฟ + 3Cl 2 = ถึง=> 2FeCl 3 – เฟอร์ริกคลอไรด์ (lll)
ไอโอดีนซึ่งเป็นตัวออกซิไดซ์ที่อ่อนแอที่สุดในบรรดาฮาโลเจนจะออกซิไดซ์เหล็กเฉพาะกับสถานะออกซิเดชัน +2:
เฟ + ฉัน 2 = ถึง=> FeI 2 – เหล็กไอโอไดด์ (ll)
ควรสังเกตว่าสารประกอบเหล็กเฟอร์ริกออกซิไดซ์ไอออนไอโอไดด์ในสารละลายที่เป็นน้ำได้อย่างง่ายดายเพื่อให้ไอโอดีนอิสระ I 2 ในขณะที่ถูกรีดิวซ์เป็นสถานะออกซิเดชัน +2 ตัวอย่างปฏิกิริยาที่คล้ายกันจากธนาคาร FIPI:
2FeCl 3 + 2KI = 2FeCl 2 + I 2 + 2KCl
2เฟ(OH) 3 + 6HI = 2เฟฉัน 2 + ฉัน 2 + 6H 2 O
เฟ 2 O 3 + 6HI = 2เฟฉัน 2 + ฉัน 2 + 3H 2 O
ด้วยไฮโดรเจน
เหล็กไม่ทำปฏิกิริยากับไฮโดรเจน (เฉพาะโลหะอัลคาไลและดินอัลคาไลน์เท่านั้นที่ทำปฏิกิริยากับไฮโดรเจนจากโลหะ):
ปฏิกิริยากับสารที่ซับซ้อน
ปฏิกิริยากับกรด
ด้วยกรดที่ไม่ออกซิไดซ์
เนื่องจากเหล็กอยู่ในชุดกิจกรรมทางด้านซ้ายของไฮโดรเจน ซึ่งหมายความว่าเหล็กสามารถแทนที่ไฮโดรเจนจากกรดที่ไม่ออกซิไดซ์ได้ (กรดเกือบทั้งหมดยกเว้น H 2 SO 4 (เข้มข้น) และ HNO 3 ที่มีความเข้มข้นใดๆ ก็ตาม):
Fe + H 2 SO 4 (เจือจาง) = FeSO 4 + H 2
เฟ + 2HCl = FeCl 2 + H 2
คุณต้องใส่ใจกับเคล็ดลับนี้ค่ะ งานสอบ Unified Stateเป็นคำถามในหัวข้อว่าเหล็กออกซิเดชันจะออกซิไดซ์ได้ระดับใดเมื่อสัมผัสกับกรดไฮโดรคลอริกเข้มข้นและเจือจาง คำตอบที่ถูกต้องคือ +2 ในทั้งสองกรณี
กับดักนี้อยู่ที่ความคาดหวังตามสัญชาตญาณของการเกิดออกซิเดชันของเหล็กในระดับลึกยิ่งขึ้น (ถึง +3) ในกรณีที่มีปฏิกิริยากับกรดไฮโดรคลอริกเข้มข้น
ปฏิกิริยากับกรดออกซิไดซ์
ภายใต้สภาวะปกติ เหล็กจะไม่ทำปฏิกิริยากับกรดซัลฟิวริกและกรดไนตริกเข้มข้นเนื่องจากการทู่ อย่างไรก็ตาม มันจะทำปฏิกิริยากับพวกมันเมื่อถูกต้ม:
2เฟ + 6H 2 SO 4 = หรือ=> เฟ 2 (SO 4) 3 + 3SO 2 + 6H 2 O
เฟ + 6HNO3 = หรือ=> เฟ(หมายเลข 3) 3 + 3NO 2 + 3H 2 โอ
โปรดทราบว่ากรดซัลฟิวริกเจือจางจะทำให้เหล็กออกซิไดซ์เป็นสถานะออกซิเดชันที่ +2 และกรดซัลฟิวริกเข้มข้นเป็น +3
การกัดกร่อน (สนิม) ของเหล็ก
ในอากาศชื้น เหล็กจะเกิดสนิมเร็วมาก:
4เฟ + 6H 2 โอ + 3O 2 = 4เฟ(OH) 3
เหล็กไม่ทำปฏิกิริยากับน้ำหากไม่มีออกซิเจน ไม่ว่าจะในสภาวะปกติหรือเมื่อต้มก็ตาม ปฏิกิริยากับน้ำเกิดขึ้นเฉพาะที่อุณหภูมิสูงกว่าความร้อนสีแดง (>800 o C) เหล่านั้น..
1. 2H 2SO 4 (เข้มข้น) + Cu = CuSO 4 + SO 2 + 2H 2O
คอปเปอร์ซัลเฟต
H 2SO 4 (เจือจาง) + Zn = ZnSO 4 + H 2
ซิงค์ซัลเฟต
2. FeO + H 2 = Fe + H 2O
CuSO 4 + Fe = Cu↓ + FeSO 4
3. ผสมเกลือของกรดไนตริก:
สูตรกรดไนตริก HNO3 กรดตกค้าง NO3--ไนเตรต
มาสร้างสูตรเกลือกันเถอะ:
Na+NO3- ใช้ตารางความสามารถในการละลาย เพื่อกำหนดค่าของไอออน เนื่องจากโซเดียมไอออนและไนเตรตไอออนมีประจุ "+" และ "-" ตามลำดับ จึงไม่จำเป็นต้องใช้ตัวห้อยในสูตรนี้ คุณจะได้รับสูตรต่อไปนี้:
Na+NO3- - โซเดียมไนเตรต
Ca2+NO3- - เมื่อใช้ตารางความสามารถในการละลาย เราจะหาประจุของไอออน ตามกฎแห่งไม้กางเขนเราจะจัดเรียงดัชนี แต่เนื่องจากไนเตรตไอออนเป็นไอออนเชิงซ้อนที่มีประจุ "-" จึงต้องอยู่ในวงเล็บ:
Ca2+(NO3)-2 - แคลเซียมไนเตรต
Al3+NO3- - เมื่อใช้ตารางความสามารถในการละลาย เราจะหาประจุของไอออน ตามกฎแห่งไม้กางเขนเราจะจัดเรียงดัชนี แต่เนื่องจากไนเตรตไอออนเป็นไอออนเชิงซ้อนที่มีประจุ "-" จึงต้องอยู่ในวงเล็บ:
Al3+(NO3)-3 - อะลูมิเนียมไนเตรต
โลหะเพิ่มเติม
ซิงค์คลอไรด์ ZnCl2
อลูมิเนียมไนเตรตอัล (NO3)3