Mi a mitokondriumok DNS-molekulája? A mitokondriális DNS tanulmányozásának fontossága. Mitokondriális betegségek és diagnózisuk
Bevezetés
A mitokondriumokban található DNS-molekulák felfedezése óta negyed évszázad telt el, mire nemcsak a molekuláris biológusok és a citológusok, hanem a genetikusok, az evolucionisták, valamint a paleontológusok és a törvényszéki tudósok is érdeklődtek. Ezt a széles körű érdeklődést A. Wilson, a Kaliforniai Egyetem munkája váltotta ki. 1987-ben közzétette az öt földrészen élő összes emberi faj különböző etnikai csoportjainak 147 képviselőjétől vett mitokondrium DNS összehasonlító elemzésének eredményeit. Az egyes mutációk típusa, helye és száma alapján megállapították, hogy az összes mitokondriális DNS divergenciával egy ősi nukleotidszekvenciából származik. Az áltudományos sajtóban ezt a következtetést rendkívül leegyszerűsítve értelmezték - az egész emberiség egy mitokondriális Éva nevű nőből származott (mivel mind a lánya, mind a fia csak édesanyjától kap mitokondriumot), aki körülbelül 200 ezer évvel ezelőtt élt Északkelet-Afrikában. ... További 10 év elteltével sikerült megfejteni a neandervölgyi darazsakból izolált mitokondriális DNS-töredéket, és megbecsülni az ember és a neandervölgyi utolsó közös őse életének 500 ezer évvel ezelőtti életét.
Manapság az emberi mitokondriális genetika intenzíven fejlődik mind a populáció, mind az orvosi szempontból. Összefüggést állapítottak meg számos súlyos örökletes betegség és a mitokondriális DNS hibái között. Az öregedéssel járó genetikai változások a mitokondriumokban a legkifejezettebbek. Mi az a mitokondriális genom, amely emberben és más állatokban eltér a növények, gombák és protozoonok méretétől, alakjától és genetikai kapacitásától? Mi a szerepe, hogyan működik és hogyan keletkezett a mitokondriális genom a különféle taxonokban általában és különösen az emberekben? Erről lesz szó a "legkisebb és legszerényebb" esszémben.
A DNS mellett a mitokondriális mátrix saját riboszómákat tartalmaz, amelyek sok jellemzőjükben különböznek az endoplazmatikus retikulum membránjain elhelyezkedő eukarióta riboszómáktól. A mitokondrium riboszómáin azonban az összetételüket alkotó összes fehérje legfeljebb 5% -a képződik. A mitokondrium szerkezeti és funkcionális komponenseit alkotó fehérjék többségét a nukleáris genom kódolja, szintetizálja az endoplazmatikus retikulum riboszómáin, és csatornáin keresztül szállítja a gyülekezési helyre. Így a mitokondrium két genom, valamint két transzkripciós és transzlációs gép együttes erőfeszítéseinek eredménye. A mitokondriális légzési lánc egyes alegység enzimjei különböző polipeptidekből állnak, némelyiket a nukleáris, másokat a mitokondriális genom kódolja. Például az oxidatív foszforiláció kulcsfontosságú enzimje, az élesztőben lévő citokróm c-oxidáz három alegységből áll, amelyeket mitokondriumokban kódolnak és szintetizálnak, és négyből a sejtmag kódolja és a citoplazmában szintetizálják. A legtöbb mitokondriális gén expresszióját a sejtben található specifikus gének szabályozzák.
A mitokondriumok eredetének szimbiotikus elmélete
Az intracelluláris baktériumok-endoszimbiontok mitokondriumainak és növényi plasztidjainak eredetéről szóló hipotézist R. Altman még 1890-ben fogalmazta meg. A fél évszázaddal ezelőtt megjelenő biokémia, citológia, genetika és molekuláris biológia gyors fejlődésének évszázada során a hipotézis nagy mennyiségű tényanyagon alapuló elméletté nőtte ki magát. ... Lényege a következő: a fotoszintetizáló baktériumok megjelenésével a Föld légkörében felhalmozódott oxigén - anyagcseréjük mellékterméke. Koncentrációjának növekedésével az anaerob heterotrófok élete bonyolultabbá vált, és közülük néhány az energia megszerzése érdekében az anoxiás fermentációtól az oxidatív foszforilációig ment át. Az ilyen aerob heterotrófok az anaerob baktériumoknál nagyobb hatásfokkal lebonthatják a fotoszintézis eredményeként képződött szerves anyagokat. A szabadon élő aerobok egy részét anaerobok fogták el, de nem „emésztették meg”, hanem energiaállomásokként, mitokondriumként őrizték meg őket. A mitokondriumokat nem szabad rabszolgáknak tekinteni, akik fogságba esnek, hogy a sejteket lélegezni képtelen ATP-molekulákkal látják el. Inkább olyan „lények”, akik még a proterozoikumban megtalálták a legjobb menedékhelyeket maguknak és utódaiknak, ahol a legkevesebb erőfeszítést teheti anélkül, hogy megkockáztatnák, hogy megessék.
Számos tény szól a szimbiotikus elmélet mellett:
A mitokondrium és a szabadon élő aerob baktériumok mérete és alakja azonos; mindkettő olyan kör alakú DNS-molekulákat tartalmaz, amelyek nem kapcsolódnak hisztonokhoz (ellentétben a lineáris mag-DNS-sel);
A nukleotidszekvenciákat tekintve a mitokondrium riboszomális és transzport RNS-i eltérnek a nukleárisaktól, miközben meglepő hasonlóságot mutatnak egyes aerob gram-negatív eubaktériumok analóg molekuláival;
A mitokondriális RNS polimerázokat, bár kódolják a sejtmagban, a rifampicin gátolja, mint a baktériumoké, és az eukarióta RNS polimerázok érzéketlenek erre az antibiotikumra;
A mitokondriumokban és a baktériumokban a fehérjeszintézist ugyanazok az antibiotikumok gátolják, amelyek nem befolyásolják az eukarióták riboszómáit;
A mitokondrium belső membránjának és a bakteriális plazmalemma lipidösszetétele hasonló, de nagyon különbözik a mitokondrium külső membránjától, amely homológ az eukarióta sejtek más membránjaival;
A belső mitokondriális membrán által képzett cristae számos prokarióta mezoszomális membránjának evolúciós analógja;
A köztes formákat utánzó szervezetek a baktériumokból származó mitokondriumok kialakulásának útján (primitív amőba Pelomyxa mitokondriuma nincs, de mindig endoszimbióta baktériumokat tartalmaz).
Van egy elképzelés, amely szerint az eukarióták különböző királyságainak különböző ősei voltak, és az élő szervezetek evolúciójának különböző szakaszaiban bakteriális endoszimbiózis keletkezett. Ezt bizonyítják a protozoonok, gombák, növények és magasabb rendű állatok mitokondriális genomjainak felépítésében mutatkozó különbségek is. De minden esetben a promitokondriumok génjeinek nagy része a sejtmagba került, valószínűleg mobil genetikai elemek segítségével. Amikor az egyik szimbionta genomjának egy része bekerül a másik genomjába, a szimbiontok integrációja visszafordíthatatlanná válik. Az új genom olyan anyagcsere útvonalakat hozhat létre, amelyek olyan hasznos termékek kialakulásához vezetnek, amelyeket egyetlen partner sem képes szintetizálni. Tehát a szteroid hormonok szintézise a mellékvese kéreg sejtjei során bonyolult reakciólánc, amelyek egy része a mitokondriumokban, másik része az endoplazmatikus retikulumban fordul elő. A promitokondriumok génjeinek megragadásával a sejtmag megbízhatóan irányítani tudta a szimbiont funkcióit. A magban a mitokondrium külső membránjának összes fehérje és lipidszintézise, \u200b\u200ba mátrix fehérjéinek nagy része és az organellumok belső membránja kódolódik. Ami a legfontosabb, hogy a mag az mtDNS replikációs, transzkripciós és transzlációs enzimeit kódolja, ezáltal szabályozza a mitokondrium növekedését és szaporodását. A szimbiotikus partnerek növekedési ütemének körülbelül azonosnak kell lennie. Ha a gazda gyorsabban növekszik, akkor minden generációval csökken az egyénre jutó szimbiontok száma, és végül lesznek olyan utódok, akiknek nincs mitokondriumuk. Tudjuk, hogy egy szexuálisan szaporodó szervezet minden sejtje sok mitokondriumot tartalmaz, amelyek megismétlik DNS-jüket a gazda osztódása közötti intervallumban. Ez biztosítja, hogy mindegyik leánysejt megkapja a mitokondriális genom legalább egy példányát.
A sejtmag szerepe a mitokondriális biogenezisben
Egy bizonyos típusú mutáns élesztőnek kiterjedt deléciója van a mitokondriális DNS-ben, ami a fehérjeszintézis teljes leállításához vezet a mitokondriumokban; ennek eredményeként ezek az organellák nem képesek ellátni funkciójukat. Mivel ezek a mutánsok kis kolóniákat képeznek, ha alacsony glükóztartalmú táptalajon növesztik őket, ezeket nevezzük citoplazmatikus mutantsvékony.
Noha a petite mutánsok nem rendelkeznek mitokondriális fehérjeszintézissel, ezért nem alkotnak normális mitokondriumot, az ilyen mutánsok mégis tartalmaznak promitochondria,amelyek bizonyos mértékben hasonlítanak a közönséges mitokondriumokhoz, normál külső és belső membránjuk rosszul fejlett cristae-val rendelkezik. A promitokondriumban számos enzim található, amelyeket nukleáris gének kódolnak és szintetizálnak a citoplazma riboszómáin, beleértve a DNS- és RNS-polimerázokat, a citromsav-ciklus összes enzimét és sok fehérjét, amelyek a belső membránt alkotják. Ez egyértelműen bizonyítja a nukleáris genom domináns szerepét a mitokondriális biogenezisben.
Érdekes megjegyezni, hogy bár az elveszett DNS-fragmensek a mitokondriális genom 20–99,9% -át teszik ki, a petite mutánsokban a mitokondriális DNS teljes mennyisége mindig ugyanazon a szinten marad, mint a vad típusban. Ennek oka a még mindig rosszul vizsgált DNS-amplifikációs folyamat, amelynek eredményeként egy DNS-molekula képződik, amely ugyanazon régió tandem ismétlődéseiből áll, és mérete megegyezik egy normál molekulával. Például a petite mutáns mitokondriális DNS-e, amely a vad típusú DNS nukleotidszekvenciájának 50% -át megtartja, két ismétlésből áll, míg egy molekula, amely csak a 0,1% a vad típusú genom a fennmaradó töredék 1000 példányából épül fel. Így a petit mutánsok felhasználhatók a mitokondriális DNS bizonyos régióinak kinyerésére, amelyeket - mondhatni - maga a természet klónoz.
Noha az organellák biogenezisét főként nukleáris gének irányítják, maguk az organellák bizonyos adatok alapján ítélve valamilyen szabályozói hatást gyakorolnak a visszacsatolás elvére; mindenesetre a mitokondriumokkal ez a helyzet. Ha az ép sejtek mitokondriumában blokkolja a fehérjeszintézist, akkor a DNS, az RNS és a fehérjék mitokondriális szintézisében részt vevő enzimek feleslegesen kezdenek kialakulni a citoplazmában, mintha a sejt megpróbálná legyőzni a blokkolószer hatását. De bár a mitokondriumokból származó valamilyen jel létezése kétségtelen, annak jellege még mindig nem ismert.
Számos okból a mitokondriális biogenezis mechanizmusait a legtöbb esetben a kultúrákban tanulmányozzák Saccharomyces carlsbergensis (sörélesztő és S. cerevisiae (sütőélesztő). Először is, amikor glükózon nőnek, ezek az élesztők egyedülálló képességgel rendelkeznek, hogy csak glikolízissel létezhetnek, vagyis mitokondriális funkció nélkül. Ez lehetővé teszi a mitokondriális és a nukleáris DNS mutációinak tanulmányozását, amelyek megakadályozzák ezen organellák fejlődését. Az ilyen mutációk szinte minden más organizmusban halálosak. Másodszor, az élesztőt - egyszerű egysejtű eukarióták - könnyű termeszteni, és biokémiai kutatásoknak vetik alá. Végül az élesztő mind a haploid, mind a diploid fázisban szaporodhat, általában aszexuális bimbózási eljárással (aszimmetrikus mitózis). De az élesztőnek szexuális folyamata is van: időről időre két haploid sejt egyesül, és diploid zigótát képez, amely aztán vagy osztódik mitózissal, vagy meiózison megy keresztül, és ismét haploid sejteket ad. A kísérlet során az ivartalan és nemi szaporodás váltakozásának irányításával sokat megtudhat a mitokondriumok működéséért felelős génekről. Ezeknek a módszereknek a felhasználásával lehet különösen megtudni, hogy az ilyen gének lokalizálódnak-e a nukleáris DNS-ben vagy a mitokondriális DNS-ben, mivel a mitokondriális gének mutációi nem öröklődnek a nukleáris gének öröklődését szabályozó Mendel-törvények szerint.
Mitokondriális transzport rendszerek
A mitokondriumokban és a kloroplasztokban található fehérjék nagy része ezekbe az organellákba kerül a citoszolból. Ez két kérdést vet fel: hogyan irányítja a sejt a fehérjéket a megfelelő organellába, és hogyan jutnak be ezek a fehérjék?
Részleges választ kaptunk, amikor az enzim kis alegységének (S) a kloroplaszt sztrómába történő transzportját tanulmányoztuk. ribulóz-1,5-biszfoszfát-karboxilusta.Ha az egysejtű algák citoplazmájából izolált mRNS Chlamydomonas vagy borsólevelekből, amelyeket in vitro mátrixként juttatnak be egy fehérjeszintetizáló rendszerbe, akkor a kialakult sok fehérje egyikét megköti egy specifikus anti-S-antitest. Az in vitro szintetizált S-fehérjét pro-S-nek hívják, mivel körülbelül 50 aminosavmaradékkal nagyobb, mint a szokásos S-fehérje. Amikor a pro-S fehérjét ép kloroplasztokkal inkubálják, behatol az organellákba, és ott peptidáz átalakítja S-fehérjévé. Ezután az S-fehérje kötődik a kloroplaszt riboszómáin szintetizált ribulóz-1,5-biszfoszfát-karboxiláz nagy alegységéhez, és aktív enzimet képez vele a kloroplaszt stromájában.
Az S-fehérje transzfer mechanizmusa nem ismert. Úgy gondolják, hogy a pro-S a kloroplaszt külső membránján vagy a külső és a belső membrán közötti érintkezési ponton elhelyezkedő receptor fehérjéhez kötődik, majd egy energiaigényes folyamat eredményeként transzmembrán csatornákon át a stromába kerül.
A fehérjéket hasonló módon szállítják a mitokondriumokba. Ha a megtisztított élesztő mitokondriumokat újonnan szintetizált radioaktív élesztőfehérjéket tartalmazó sejtkivonattal inkubáljuk, megfigyelhető, hogy a maggenom által kódolt mitokondriális fehérjék el vannak választva a citoplazma nem mitokondriális fehérjeitől, és szelektíven beépülnek a mitokondriumba, akárcsak egy ép sejtben. Ugyanakkor a külső és a belső membrán, a mátrix és az intermembrán tér fehérjéi a megfelelő mitokondriális rekeszbe jutnak.
A belső membrán, a mátrix és az intermembrán tér számára szánt újonnan szintetizált fehérjék közül sok N-terminálisukban vezető peptidet tartalmaz, amelyet egy speciális proteáz hasít a mátrixban a szállítás során. A fehérjék átvitele ebbe a három mitokondriális rekeszbe a belső membránon keresztül létrehozott elektrokémiai protongradiens energiáját igényli. A külső membrán fehérjetranszferének mechanizmusa más: ebben az esetben sem az energiafelhasználás, sem a hosszabb prekurzor fehérje proteolitikus hasítása nem szükséges. Ezek és más megfigyelések azt sugallják, hogy a mitokondriális fehérjék mind a négy csoportja a következő mechanizmus segítségével szállítja az organellát: feltételezzük, hogy az összes fehérje, kivéve a külső membránnak szánt fehérjéket, egy energiát igénylő folyamat eredményeként bekerül a belső membránba. a külső és a belső membrán érintkezési pontjai. Nyilvánvaló, hogy a fehérje ezen első beépítése után a membránba proteolitikus hasításon megy keresztül, ami a konformációjának megváltozásához vezet; attól függően, hogy a konformáció hogyan változik, a fehérje vagy rögzül a membránban, vagy "benyomódik" a mátrixba vagy az intermembrán térbe.
A fehérjék átvitele a mitokondrium és a kloroplaszt membránján keresztül elvben analóg az endoplazmatikus retikulum membránjain keresztül történő transzferrel. Itt azonban számos fontos különbség van. Először, a mátrixba vagy a stromába szállítva a fehérje az organella külső és belső membránján egyaránt áthalad, míg az endoplazmatikus retikulum lumenjébe szállítva a molekulák csak egy membránon mennek keresztül. Ezenkívül a fehérjék átvitelét a retikulumba a mechanizmus segítségével hajtják végre irányeltávolítás(vektoriális kisülés) - akkor kezdődik, amikor a fehérje még nem hagyta el teljesen a riboszómát (társfordítási import),és a mitokondriumokba és kloroplasztokba való átvitel a fehérjemolekula szintézisének teljes befejezése után következik be (fordítás utáni import).
Ezen eltérések ellenére mindkét esetben a sejt olyan prekurzor fehérjéket szintetizál, amelyek olyan szignálszekvenciát tartalmaznak, amely meghatározza, hogy az adott fehérje melyik membránra irányul. Nyilvánvalóan sok esetben ez a szekvencia leválik a prekurzor molekuláról a transzport befejezése után. Néhány fehérje azonban a végső formában azonnal szintetizálódik. Úgy gondoljuk, hogy ilyen esetekben a szignálszekvencia a végső fehérje polipeptidláncában található. A szignálszekvenciákat még mindig rosszul értik, de valószínűleg több ilyen szekvenciának kell lennie, amelyek mindegyike meghatározza egy fehérjemolekula transzferjét a sejt egy meghatározott régiójába. Például egy növényi sejtben a fehérjék egy része, amelyek szintézise a citoszolban kezdődik, ezután a mitokondriumba, mások a kloroplasztokba, mások a peroxiszómákba, mások pedig az endoplazmatikus retikulumba kerülnek. A fehérjék helyes intracelluláris eloszlásához vezető komplex folyamatok csak mostanában érthetők meg.
A nukleinsavak és a fehérjék mellett lipidekre van szükség az új mitokondriumok felépítéséhez. A kloroplasztokkal ellentétben a mitokondriumok lipidjeik nagy részét kívülről kapják. Állati sejtekben az endoplazmatikus retikulumban szintetizált foszfolipideket speciális fehérjék segítségével a mitokondrium külső membránjába szállítják, majd beépítik a belső membránba; úgy gondolják, hogy ez a két membrán érintkezési pontján fordul elő. A lipid bioszintézis fő reakciója, amelyet maguk a mitokondriumok katalizálnak, a foszfatidinsav átalakulása foszfolipid kardiolipinné, amely főleg a belső mitokondriális membránban található meg, és az összes lipidjének mintegy 20% -át teszi ki.
A mitokondriális genomok mérete és alakja
A mai napig több mint 100 különböző mitokondriális genomot olvastak. Génjeik halmaza és száma a mitokondriális DNS-ben, amelyek esetében a nukleotid-szekvencia teljesen meghatározva van, az állatok, a növények, a gombák és a protozoonok különböző fajaiban nagyban különböznek egymástól. A legtöbb gént a flagellátum protozoon mitokondriális genomjában találjuk Rectinomo-nas americana - 97 gén, beleértve az összes fehérjét kódoló gént, amely más organizmusok mtDNS-ében található. A legtöbb magasabbrendű állatban a mitokondriális genom 37 gént tartalmaz: 13 a légzési lánc fehérjéihez, 22 a tRNS-hez, kettő pedig az rRNS-hez (a 16S rRNS nagy riboszóma alegységéhez és a kicsi 12S rRNS-hez). A növényekben és a protozoákban, ellentétben az állatokkal és a legtöbb gombával, ezeknek az organelláknak a riboszómáit alkotó fehérjék a mitokondriális genomban vannak kódolva. A templát polinukleotid szintézis kulcsfontosságú enzimjei, például a DNS-polimeráz (replikáló mitokondriális DNS) és az RNS-polimeráz (a mitokondriális genom átírása) a magban kódolódnak, és a citoplazmatikus riboszómákon szintetizálódnak. Ez a tény jelzi a mitokondriális autonómia relativitását az eukarióta sejt komplex hierarchiájában.
A különböző fajok mitokondriumainak genomjai nemcsak a gének halmazában, elrendeződésük és expressziójuk sorrendjében, hanem a DNS méretében és alakjában is különböznek. A ma leírt mitokondriális genomok túlnyomó többsége körkörös szuper tekercses kétszálú DNS-molekula. Néhány növényben a kör alakúak mellett lineárisak is vannak, egyes protozoákban, például ciliákokban, a mitokondriumokban csak lineáris DNS található.
Általános szabály, hogy minden mitokondrium genomjának több példányát tartalmazza. Tehát az emberi máj sejtjeiben körülbelül 2000 mitokondrium található, és mindegyik 10 azonos genomot tartalmaz. Az egér fibroblasztjaiban 500 mitokondrium található, amely két genomot tartalmaz, és az élesztősejtekben S. cerevisiae - legfeljebb 22 mitokondrium négy genommal.
DIV_ADBLOCK1003 "\u003e
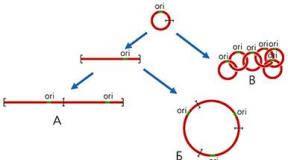
 2. ábra Lineáris (A), kör alakú (B), lánc (C) mtDNS oligomerek képződési diagramja. ori - a DNS replikáció kezdetének régiója.
2. ábra Lineáris (A), kör alakú (B), lánc (C) mtDNS oligomerek képződési diagramja. ori - a DNS replikáció kezdetének régiója.
A különböző organizmusok mitokondriális genomjának mérete a malária plazmodium kevesebb mint 6 ezer bázispárjától (két rRNS-gén mellett csak három fehérjét kódoló gént tartalmaz) és százezrekig terjedő szárazföldi növények nukleotidpárjaitól (például Arabidopsis thaliana a keresztes családból 366924 bázispár). Ugyanakkor a magasabb rendű növények mtDNS-jének nagyságában 7-8-szoros különbségek tapasztalhatók még ugyanazon családon belül is. A gerincesek mtDNS-ének hossza kissé eltér: emberben - 16 569 bázispár, sertésben - 16350, delfinben - 16330, karmos békában Xenopus laevis - 17533, pontyokban - 16400. Ezek a genomok hasonlóak a gének lokalizációjában is, amelyek többsége végpontok között helyezkedik el; egyes esetekben még átfedik egymást, általában egy nukleotiddal, így az egyik gén utolsó nukleotidja az első a következőben. A gerincesekkel ellentétben, növényekben, gombákban és protozoákban az mtDNS-ek a nem kódoló szekvenciák 80% -át is tartalmazzák. A mitokondriális genomokban található gének sorrendje fajonként eltér.
A reaktív oxigénfajták magas koncentrációja a mitokondriumokban és a gyenge javítórendszer nagyságrenddel megnöveli az mtDNS mutációk gyakoriságát a nukleárishoz képest. Az oxigéngyökök a C®T (citozin dezaminálása) és a GT®T (a guanin oxidatív károsodása) specifikus szubsztitúcióit okozzák, aminek eredményeként esetleg az mtDNS AT-párokban gazdag. Ezenkívül minden mtDNS-nek érdekes tulajdonsága van - nem metilezettek, ellentétben a nukleáris és a prokarióta DNS-sel. Ismeretes, hogy a metilezés (a nukleotidszekvencia ideiglenes kémiai módosítása a DNS kódoló funkciójának megzavarása nélkül) a programozott géninaktiválás egyik mechanizmusa.
A DNS-molekulák mérete és szerkezete organellákban
Szerkezet | Tömeg, millió dalton | Megjegyzések |
||
|
ohhon drya | Állatok | Gyűrűs | Minden fajnak azonos méretű molekulái vannak |
|
Magasabb ras sthenia | Gyűrűs | Váltakozik | Valamennyi vizsgált faj különböző méretű körkörös DNS-sel rendelkezik, amelyben a genetikai információ teljes tartalma a fajtól függően 300-1000 millió dalton tömegnek felel meg |
|
Gomba: A legegyszerűbb | Gyűrűs Gyűrűs Gyűrűs Lineáris | |||
|
Klór opla kályha | Hínár | Gyűrűs Gyűrűs | ||
Magasabb növények | Gyűrűs | Minden egyes fajnak csak egy molekulája van |
A DNS-organellák relatív mennyisége egyes sejtekben és szövetekben
Szervezet | Szövet vagy sejttípus | A mol-l DNS / organella száma | Orgona száma nell be ketrec | Az organelle DNS aránya az összesben Sejt DNS,% |
|
|
ohhon drya | |||||
L vonal sejtjei | |||||
Tojás | |||||
|
Klór opla kályha | Vegetatív diploid sejtek | ||||
Kukorica |
A mitokondriális genom működése
Mi különleges az emlős mitokondriális DNS replikációs és transzkripciós mechanizmusaiban?
Az mtDNS-ben a kiegészítő "href \u003d" / text / category / komplementarij / "rel \u003d" bookmark "\u003e komplementer szálak fajlagos súlyukban jelentősen különböznek, mivel egyenlőtlen mennyiségű„ nehéz ”purint és„ könnyű ”pirimidin-nukleotidot tartalmaznak. Így hívják őket - H (nehéz - nehéz) és L (könnyű - könnyű) lánc. Az mtDNS-molekula replikációjának kezdetén egy úgynevezett D-hurok (az angol Displace-ment hurokból) képződik. Ez az elektronikus mikro- osp, kettős szálú és egyszálú (a H-lánc visszahúzott része) szakaszokból áll. A kettős szálú szakaszt az L-lánc egy része és egy komplementer, újonnan szintetizált, 450-650 (a szervezet típusától függően) 5 "- a ribonukleotidmag vége, amely megfelel a H-lánc (oriH) szintézisének kiindulópontjának. Az L-lánc szintézise csak akkor kezdődik, amikor a leány H-lánc eléri az ori L. pontot. Ez annak a ténynek köszönhető, hogy az L-lánc replikációs iniciációjának régiója a DNS-szintézis enzimjei számára csak egyszálú állapotban, és következésképpen csak letekeredve érhető el kettős spirál a H-lánc szintézisében. Így az mtDNS leányszálakat szintetizálják folyamatosan és aszinkron módon (3. ábra).
3. ábraEmlős mtDNS replikációs séma. Először a D-hurok képződik, majd a leány H-lánc szintetizálódik, majd megkezdődik a leány L-lánc szintézise.
A 16S rRNS gén vége (4. ábra). 10-szer több ilyen rövid átirat van, mint hosszú. Az érlelés (feldolgozás) eredményeként 12S rRNS és 16S rRNS képződik belőlük, amelyek részt vesznek a mitokondriális riboszómák, valamint a fenilalanin és valin tRNS képződésében. A fennmaradó tRNS-eket kivágjuk a hosszú transzkriptumokból, és transzlált mRNS-ek képződnek, amelyek 3 "végéhez poliadenil-szekvenciák kapcsolódnak. Ezen mRNS-ek 5" -es végei nincsenek lezárva, ami az eukarióták számára szokatlan. Nem történik splicing (splicing), mivel az emlősök egyik mitokondriális génje nem tartalmaz intront.
4. ábra 37 gént tartalmazó humán mtDNS átírása. Minden transzkriptum szintetizálni kezd az ori H régióban, a riboszomális RNS-eket kivágják a hosszú és rövid H lánc transzkriptumokból. A tRNS és az mRNS mindkét DNS-szál átiratából történő feldolgozás eredményeként keletkezik. A tRNS gének világoszöld színnel vannak feltüntetve.
Szeretné tudni, milyen további meglepetéseket okozhat a mitokondriális genom? Bírság! Olvass tovább! ..
A vezető és a 3'-nem kódoló régiók, mint a legtöbb nukleáris mRNS. Számos gén is tartalmaz intront. Így a citokróm-oxidáz b kódoló box-génben két intron található. Az elsődleges RNS-transzkriptumból autokatalitikusan (semmilyen részvétel nélkül) vagy fehérjék), az első intron nagy részének másolatát kivágják. A fennmaradó RNS templátként szolgál a splicingben részt vevő maturáz enzim képződéséhez. Aminosav-szekvenciájának egy részét az intronok fennmaradó másolatai kódolják. A Maturase kivágja őket, elpusztítva saját mRNS-jét, Az exonok másolatait varrják, és kialakul a citokróm-oxidáz b mRNS-je (5. ábra). Egy ilyen jelenség felfedezése arra kényszerített bennünket, hogy vizsgáljuk felül az intronok „semmi kódoló szekvenciát” fogalmát.
5. ábra A citokróm-oxidáz b mRNS feldolgozása (érlelése) élesztő mitokondriumokban. A splicing első szakaszában mRNS képződik, amely révén a maturase szintetizálódik, ami szükséges a splicing második szakaszához.
A mitokondriális gének expressziójának tanulmányozása során Trypanosoma brucei meglepő eltérést fedeztek fel a molekuláris biológia egyik alapvető axiómájától, amely kimondja, hogy az mRNS nukleotidszekvenciája pontosan megegyezik a DNS kódoló régióinak szekvenciájával. Kiderült, hogy a citokróm c-oxidáz egyik alegységének mRNS-jét szerkesztik, vagyis a transzkripció után megváltozik az elsődleges szerkezete - négy uracil kerül beillesztésre. Ennek eredményeként egy új mRNS képződik, amely sablonként szolgál az enzim további alegységének szintéziséhez, aminosav-szekvenciának nincs köze a szekvenciához. Vírus "href \u003d" / text / category / virus / "rel \u003d" bookmark "\u003e vírusok, gombák, Az angol kutató, Burrell összehasonlította az egyik borjú mitokondriális gén szerkezetét a citokróm-oxidáz alegységben található aminosavak szekvenciájával, amelyet ez a gén kódolt. Kiderült, hogy a szarvasmarhák (valamint az emberek) mitokondriumainak genetikai kódja nem csak az univerzálistól eltér, „ideális”, vagyis a következő szabálynak felel meg: „ha két kodonnak két azonos nukleotidja van, és a harmadik nukleotid ugyanahhoz az osztályhoz tartozik (purin - A, G vagy pirimidin - Y, C), akkor kódolja ugyanazt az aminosavat. ”Az univerzális kódban két kivétel van e szabály alól: az AUA triplett izoleucint, az AUG kodon pedig metionint kódol, míg az ideális mitokondriális kódban mindkét hármas oder metionin; az UGG triplett csak a triptofánt kódolja, az UGA triplett pedig egy stop kodont. Az univerzális kódban mindkét eltérés a fehérjeszintézis alapvető mozzanataira vonatkozik: az AUG kodon a iniciátor, az UGA stop kodon pedig leállítja a polipeptid szintézist. Az ideális kód nem mindegyik leírt mitokondriumban rejlik, de egyiküknek sincs univerzális kódja. Elmondható, hogy a mitokondrium különböző nyelveket beszél, de soha nem a mag nyelvét.
Különbségek az „univerzális” genetikai kód és a két mitokondriális kód között
Codon | Mitokondriális emlős kód | Mitokondriális élesztő kód | “ Egyetemes” |
Mint már említettük, a gerincesek mitokondriális genomjában 22 tRNS-gén található. Hogyan szolgálja egy ilyen hiányos készlet az aminosavak mind a 60 kodonját (64 hármas ideális kódjában négy stopkodon van, egyetemesben három -?) Az a tény, hogy a mitokondriumokban a fehérjeszintézis során a kodon-antikodon kölcsönhatások egyszerűsödnek - a három antikodon nukleotid közül kettőt használnak felismerésre. Így egy tRNS felismeri a kodon család mind a négy tagját, amelyek csak a harmadik nukleotidban különböznek egymástól. Például a GAU antikodonnal rendelkező leucin tRNS a COSU, CUC, CUA és CUG kodonokkal szemben áll a riboszómán, biztosítva a leucin hibamentes beépülését a polipeptidláncba. A másik két leucin kodont, az UUA-t és az UUG-t a tRNS felismeri az antikodon AAU-val. Összességében nyolc különböző tRNS-molekula nyolc, egyenként négy kodonból álló családot ismer fel, és 14 tRNS különböző kodonpárokat, amelyek mindegyike egy-egy aminosavat kódol.
Fontos, hogy az aminosavaknak a mitokondrium megfelelő tRNS-hez való kapcsolódásáért felelős aminoacil-tRNS-szintetáz enzimeket a sejtmag kódolja, és szintetizálja az endoplazmatikus retikulum riboszómáin. Így a gerinceseknél a mitokondriális polipeptid szintézis összes fehérjekomponense a magban van kódolva. Ugyanakkor a mitokondriumokban a fehérjeszintézist nem gátolja a cikloheximid, amely blokkolja az eukarióta riboszómák munkáját, de érzékeny az eritromicin és klóramfenikol antibiotikumokra, amelyek gátolják a fehérjék szintézisét a baktériumokban. Ez a tény szolgál az egyik érvként az aerob baktériumok mitokondriumainak eredete mellett az eukarióta sejtek szimbiotikus képződése során.
A saját genetikai rendszerének fontossága a mitokondriumokban
Miért van szükségük a mitokondriumoknak a saját genetikai rendszerükre, míg más organellumokban, például a peroxiszómákban és a lizoszómákban nincs? Ez a kérdés egyáltalán nem triviális, mivel a külön genetikai rendszer fenntartása egy sejt számára költséges, tekintettel a szükséges számú további génre a nukleáris genomban. Itt kódolni kell a riboszomális fehérjéket, az aminoacil-tRNS-szintetázokat, a DNS- és az RNS-polimerázokat, az RNS-feldolgozó és a módosító enzimeket stb. okkal feltételezhető, hogy ezekben a szervekben nagyon kevés olyan fehérje van, amely másutt megtalálható lenne. Ez azt jelenti, hogy a mitokondriumok genetikai rendszerének fenntartása érdekében a nukleáris genomnak több tucat további génnel kell rendelkeznie. Ennek a „pazarlásnak” az okai nem tisztázottak, és nem volt igaz az a remény, hogy a mitokondriális DNS nukleotidszekvenciájában találnak nyomot. Nehéz elképzelni, hogy miért kell a mitokondriumban képződő fehérjéket szintetizálni, és nem a citoszolban.
Általában a genetikai rendszer létezését az energiaorganellákban azzal magyarázzák, hogy az organelle belsejében szintetizált fehérjék egy része túl hidrofób ahhoz, hogy kívülről átjuthasson a mitokondriális membránon. Az ATP-szintetáz komplex tanulmányozása azonban azt mutatta, hogy egy ilyen magyarázat valószínűtlen. Bár az ATP-szintetáz egyes fehérje-alegységei az evolúció során erősen konzerváltak, szintézisük helyei megváltoznak. A kloroplasztokban számos meglehetősen hidrofil fehérje, köztük a komplex F1-ATPáz részének öt alegységéből négy képződik az organellán belüli riboszómákon. Épp ellenkezőleg, a gombánál Neurospora állati sejtekben az ATPáz membrán részének egy nagyon hidrofób komponense (9. alegység) szintetizálódik a citoplazmatikus riboszómákon, és csak azután jut át \u200b\u200baz organellába. A funkcionálisan ekvivalens fehérjék alegységeit kódoló gének különbözõ lokalizációját a különbözõ organizmusokban nehéz megmagyarázni olyan hipotézisek segítségével, amelyek a mitokondrium és kloroplasztika modern genetikai rendszereinek bizonyos evolúciós elõnyeit feltételezik.
A fentieket figyelembe véve csak azt kell feltételezni, hogy a mitokondriumok genetikai rendszere evolúciós zsákutca. Az endo-szimbiotikus hipotézis keretein belül ez azt jelenti, hogy az endosymbiont gének átvitelének folyamata a gazdaszervezet nukleáris genomjába még azelőtt befejeződött, hogy teljesen befejeződött.
Citoplazmatikus öröklés
A citoplazmatikus géntranszfer következményei egyes állatokra, beleértve az embereket is, súlyosabbak, mint az élesztő esetében. Két összeolvadó haploid élesztősejt azonos méretű és azonos mennyiségű mitokondriális DNS-sel járul hozzá a kapott zigótához. Élesztőben tehát a mitokondriális genom mindkét szülőtől öröklődik, amelyek egyenlő mértékben járulnak hozzá az utódok génállományához (bár több generáció után különállóaz utódok gyakran csak az egyik szülőtípus mitokondriumát tartalmazzák). Ezzel szemben a magasabb rendű állatoknál a petesejt több citoplazmát visz be a zigótába, mint a spermium, és egyes állatoknál a sperma egyáltalán nem adhat citoplazmát. Ezért azt gondolhatjuk, hogy magasabb rendű állatoknál a mitokondriális genom csak egy szülőtől (nevezetesen: anyaivonalak); valóban ezt kísérletekkel igazolták. Kiderült például, hogy amikor két laboratóriumi vonal patkányát keresztezik mitokondriális DNS-sel, amely a nukleotidok szekvenciájában kissé eltér (A és B típus), akkor olyan utódokat kapunk, amelyek
csak anyai típusú mitokondriális DNS-t tartalmaz.
A citoplazmatikus öröklődés, ellentétben az atomokkal, nem engedelmeskedik Mendel törvényeinek. Ez annak a ténynek köszönhető, hogy magasabb rendű állatoknál és növényeknél a különböző nemű ivarsejtek összehasonlíthatatlan mennyiségű mitokondriumot tartalmaznak. Tehát az egér tojásában 90 ezer mitokondrium található, a spermiumokban pedig csak négy. Nyilvánvaló, hogy a megtermékenyített petesejtben a mitokondriumok túlnyomórészt vagy csak nősténytől származnak, vagyis az összes mitokondriális gén öröklődése anyai. A citoplazmatikus öröklődés genetikai elemzése nehéz a nukleáris-citoplazmatikus kölcsönhatások miatt. Citoplazmatikus hímsterilitás esetén a mutáns mitokondriális genom kölcsönhatásba lép a sejtmag bizonyos génjeivel, amelyek recesszív alléljai szükségesek a tulajdonság kialakulásához. E gének domináns alléljai, mind homo-, mind heterozigóta állapotokban, a mitokondriális genom állapotától függetlenül helyreállítják a növények termékenységét.
Konkrét példával szeretnék kitérni a gének anyai öröklődésének mechanizmusára. A mitokondriális gének nem-mendeli (citoplazmatikus) öröklődésének mechanizmusának végleges és visszavonhatatlan megértése érdekében vegyük fontolóra, mi történik az ilyen génekkel, amikor két haploid sejt összeolvad és diploid zigótát képez. Abban az esetben, ha az egyik élesztősejt mutációt hordoz, amely meghatározza a mitokondriális fehérjeszintézis rezisztenciáját a kloramfenikollal szemben, a másik pedig egy vad típusú sejt érzékeny erre az antibiotikumra: a mutáns gének könnyen azonosíthatók az élesztő glicerin tartalmú táptalajon történő növesztésével, amelyet csak az ép mitokondriummal rendelkező sejtek használhatnak; ezért kloramfenikol jelenlétében csak a mutáns gént hordozó sejtek nőhetnek ilyen közegben. Diploid zigótánk kezdetben mutáns és vad típusú mitokondriumokkal is rendelkezik. A mitózis következtében a zigótából diploid leánysejt kel ki, amely csak kis számú mitokondriumot tartalmaz. Több mitotikus ciklus után végül az egyik új sejt megkapja az összes mitokondriumot, akár mutáns, akár vad típusú. Ezért egy ilyen sejt összes utódjának genetikailag azonos mitokondriumai lesznek. Egy ilyen véletlenszerű folyamatot, amelynek eredményeként egy diploid utód képződik, amely csak egyetlen típusú mitokondriumot tartalmaz, ún. mitotikusth ímegörögországth. Amikor egy diploid sejt, amelynek csak egyetlen mitokondrium-típusa van, meiózison megy keresztül, mind a négy leány haploid sejt ugyanazokat a mitokondriális géneket kapja. Ezt a fajta öröklést hívják nemendeegy oroszlán soványvagy citoplazmatikusellentétben a nukleáris gének mendeli örökségével. A gének citoplazmatikus transzferje azt jelenti, hogy a vizsgált gének a mitokondriumokban helyezkednek el.
A mitokondriális genomok tanulmányozása, evolúciójuk a populációgenetika sajátos törvényei szerint halad, valamint a nukleáris és mitokondriális genetikai rendszerek közötti kapcsolat szükséges az eukarióta sejt és az egész szervezet komplex hierarchikus szerveződésének megértéséhez.
Bizonyos örökletes betegségek és az emberi öregedés a mitokondriális DNS vagy a mitokondriális funkciót szabályozó maggének bizonyos mutációival jár. Az adatok gyűlnek az mtDNS-hibák karcinogenezisben való részvételéről. Ezért a mitokondrium lehet a rák kemoterápiájának célpontja. Vannak tények a nukleáris és mitokondriális genomok szoros kölcsönhatásáról számos emberi patológia kialakulásában. Az mtDNS többszörös delécióját találták súlyos izomgyengeségben, ataxiában, süketségben és mentális retardációban szenvedő betegeknél, autoszomális domináns módon örököltek. Megállapított szexuális dimorfizmus a szívkoszorúér-betegség klinikai megnyilvánulásaiban, ami nagy valószínűséggel az anyai hatásnak - a citoplazmatikus öröklődésnek köszönhető. A génterápia fejlesztése reményt ad a mitokondrium genomjában fellépő hibák kijavítására belátható időn belül.
Mint tudják, a többkomponensű rendszer egyik összetevőjének működésének ellenőrzéséhez szükségessé válik ennek az összetevőnek a megszüntetése, majd a bekövetkezett változások elemzése. Mivel jelen esszé témája jelzi az anyai genom szerepét az utódok fejlődésében, logikus lenne megismerni a mitokondriális genom összetételének különböző tényezők által okozott megsértésének következményeit. A mutációs folyamat a fenti szerep tanulmányozásának eszközének bizonyult, és számunkra érdekes tevékenységének következményei az ún. mitokondriális betegségek.
A mitokondriális betegségek példák a citoplazmatikus öröklődésre az emberekben, vagy inkább az "organelle öröklődés". Ezt a pontosítást azért kell megtenni, mert mostanra bebizonyosodott, hogy legalább néhány organizmusban léteznek olyan citoplazmatikus örökletes determinánsok, amelyek nem kapcsolódnak sejtorganellumokhoz, citogénekhez (Vechtomov, 1996).
A mitokondriális betegségek a betegségek heterogén csoportja, amelyet a mitokondrium genetikai, szerkezeti, biokémiai hibái és a szöveti légzés károsodása okoz. A mitokondriális betegség diagnosztizálásához fontos egy átfogó genealógiai, klinikai, biokémiai, morfológiai és genetikai elemzés. A mitokondriális patológia fő biokémiai jele a tejsavas acidózis kialakulása, általában hiperlaktatacidémiát észlelnek hiperpiruvatacidémiával kombinálva. A különféle változatok száma elérte a 120 formát. A cerebrospinális folyadékban stabilan nő a tejsav- és pironsavkoncentráció.
A mitokondriális betegségek (MB) jelentős problémát jelentenek a modern orvoslás számára. Az örökletes átvitel módszerei szerint az MB-k között megkülönböztetnek olyan betegségeket, amelyek a Mendeli-típus szerint monogén módon öröklődnek, amelyekben a nukleáris gének mutációja miatt vagy a mitokondriális fehérjék szerkezete és működése zavart, vagy a mitokondriális DNS-ek kifejeződése, valamint a mitokondriális gének mutációi által okozott betegségek főleg az anyai vonalon keresztül jutottak az utódokhoz.
A mitokondriumok súlyos patológiáját jelző morfológiai vizsgálatok adatai: a mitokondriumok kóros proliferációja, a mitokondriumok zavart alakú és méretű polimorfizmusa, a cristaák dezorganizálódása, a kóros mitokondriumok felhalmozódása a sarcolemma alatt, parakristályos zárványok a mitochondriumokban, az interferibrilláris vakuolok jelenléte
A mitokondriális betegségek formái
1 ... Mitokondriális betegségek által okozott mitokondriális DNS mutációk
1.1 A mitokondriális DNS deléciói által okozott betegségek
1.1.1. Kearns-Sayre-szindróma
A betegség 4-18 éves korban nyilvánul meg, progresszív külső oftalmoplegia, retinitis pigmentosa, ataxia, szándékos remegés, atrioventrikuláris szívblokk, a cerebrospinalis folyadékban megnövekedett fehérjetartalom, több mint 1 g / l, "szakadt" vörös rostok a vázizmok biopsziáiban.
1.1.2 Pearson-szindróma
A betegség születésétől kezdve vagy az élet első hónapjaiban előforduló esetenként előfordulhat encephalomyopathiák, ataxia, demencia, progresszív külső oftalmoplegia, hypoplasticus vérszegénység, exokrin hasnyálmirigy-funkció károsodása, progresszív lefolyás
2 A mitokondriális DNS-pontmutációk okozta betegségek
Anyai típusú öröklés, a látásélesség hirtelen vagy szubakut csökkenése az egyik vagy mindkét szemben, kombináció neurológiai és osteoarticularis rendellenességekkel, retina mikroangiopathia, progresszív lefolyás a látásélesség remissziójának vagy helyreállításának lehetőségével, a betegség kezdete 20-30 évesen
2.2 NAPR szindróma (neuropathia, ataxia, retinitis pigmentosa)
Az anyai típusú öröklés, a neuropathia, az ataxia és a retinitis pigmentosa kombinációja, késleltetett pszichomotoros fejlődés, demencia, "elszakadt" vörös rostok jelenléte az izomszövet biopsziáiban
2.3. MERRF-szindróma (myoclonus-epilepszia, "szakadt" vörös rostok)
Anyai öröklődés típusa, a betegség 3-65 éves korban történő megjelenése, myoclonicus epilepszia, ataxia, demencia neuroszenzoros süketséggel kombinálva, a látóideg sorvadása és károsodott mély érzékenység, tejsavas acidózis, EEG vizsgálat során, általánosítás fürdőszobai epilepszia komplexek, "szakadt" vörös rostok a vázizom biopsziákban, progresszív lefolyás
2.4 MELAS-szindróma (mitokondriális encephalomyopathia, tejsavas acidózis, stroke-szerű epizódok)
Az anyai öröklődés típusa, a betegség 40 éves kor előtt bekövetkező kialakulása, testzavar-intolerancia, migrénszerű fejfájás hányingerrel és hányással, stroke-szerű epizódok, görcsök, tejsavas acidózis, „elszakadt” vörös rostok az izombiopsziákban, progresszív lefolyás.
3 .Az intergenomikus kommunikáció hibáival járó patológia
3.1 Mitokondriális DNS többszörös deléció szindrómák
Blepharoptosis, külső ophthalmoplegia, izomgyengeség, szenzineurális süketség, optikai atrófia, progresszív lefolyás, "szakadt" vörös rostok a vázizom biopsziákban, a légzési lánc enzimek aktivitásának csökkenése.
3.2 Mitokondriális DNS-deléció szindróma
Autoszomális recesszív öröklés
Klinikai formák:
3.2.1.Végzetes infantilis
a) súlyos májkárosodás b) hepatopathia c) izom hipotenzió
Debütálás az újszülött korában
3.2.2.Veleszületett myopathia
Súlyos izomgyengeség, generalizált hipotenzió, kardiomiopátia és görcsrohamok, vesekárosodás, glükózuria, aminoacidopathia, foszfaturia
3.2.3.Infantilis myopathia
az élet első 2 évében jelentkezik, progresszív izomgyengeség, a proximális izomcsoportok sorvadása és az ínreflexek elvesztése, gyorsan progresszív lefolyás, halál az élet első 3 évében.
4 A nukleáris DNS-mutációk által okozott mitokondriális betegségek
4.1 A légzési lánc hibáival járó betegségek
4.1.1 1. komplex (NADH: CoQ reduktáz) hiány
A betegség 15 éves kor előtti megjelenése, myopathia szindróma, késleltetett pszichomotoros fejlődés, károsodott szív- és érrendszer, terápiának ellenálló rohamok, többszörös neurológiai rendellenességek, progresszív lefolyás
4.1.2 2. komplex (szukcinát-CoQ reduktáz) hiány
Az encephalomyopathia szindróma, a progresszív lefolyás, az alutak, a ptosis lehetséges kialakulása jellemzi
4.1.3 3. komplex (CoQ-citokróm C-oxidoreduktáz) hiány
Multirendszeri rendellenességek, különféle szervek és rendszerek károsodása a központi és perifériás idegrendszer, az endokrin rendszer, a vesék bevonásával, progresszív lefolyás
4.1.4 Komplex (citokróm C-oxidáz) hiány
4.1.4.1 Végzetes infantilis veleszületett tejsavas acidózis
Mitokondriális myopathia veseelégtelenséggel vagy kardiomiopátiával, debütálás újszülött korban, súlyos légzési zavarok, diffúz izom-hipotónia, progresszív lefolyás, halál az élet első évében.
4.1.4.2.Jóindulatú infantilis izomgyengeség
Az atrófiák megfelelő és időben történő kezeléssel, a folyamat gyors stabilizálódásával és 1-3 éves korig történő helyreállítással lehetségesek
5 . Menkes-szindróma (trichopolyodystrophia)
A pszichomotoros fejlődés hirtelen késése, a növekedés visszamaradása, a növekedés károsodása és a haj dystrophiás változásai,
6 ... Mitokondriális encephalomyopathiák
6.1.Leigh-szindróma (szubakut neurotizáló encephalomyelopathia)
6 hónapos élet után, izomhypotonia, ataxia, nystagmus, piramis tünetek, oftalmoplegia, a látóidegek sorvadása, gyakran kardiomiopátiával és enyhe metabolikus acidózissal társulva
6.2.Alpers-szindróma (progresszív szklerotizáló polydystrophia)
Az agy szürkeállományának degenerációja májcirrhosissal, az 5. komplex hiánya (ATP-szintetáz), késleltetett pszichomotoros fejlődés, ataxia, demencia, izomgyengeség, a betegség progresszív lefolyása, rossz prognózis
6.3 Koenzim-Q hiány
Metabolikus krízisek, izomgyengeség és fáradtság, oftalmoplegia, süketség, csökkent látás, stroke-szerű epizódok, ataxia, myoclonus epilepszia, vesekárosodás: glükózuria, aminoacidopathia, foszfaturia, endokrin rendellenességek, progresszív lefolyás, a légzési lánc enzimek aktivitásának csökkenése
7 .A tejsav- és piroszavsavak káros anyagcseréjével járó betegségek
7.1. A piruvát-karboxiláz hiánya Autoszomális recesszív öröklődési mód, a betegség kialakulása az újszülött korában, a "petyhüdt gyermek" tünetegyüttese, a terápiának ellenálló görcsrohamok, a keton testek magas koncentrációja a vérben, hiperammonémia, hiperlyinemia, csökkent piruvát-karboxiláz aktivitás a vázizmokban
7.2 Piruvát-dehidrogenáz hiány
Megnyilvánulás az újszülöttkori időszakban, craniofacialis dysmorphia, terápiának ellenálló rohamok, károsodott légzés és szopás, tünetegyüttes "petyhüdt gyermek", agydysginesia, súlyos acidózis magas laktát- és piruváttartalommal
7.3 A piruvát-dehidrogenáz aktivitásának csökkenése
Megnyilvánulás az első életévben, mikrocefália, késleltetett pszichomotoros fejlődés, ataxia, izomdystonia, koreoatetózis, magas piruvát tartalmú tejsavas acidózis
7.4 Dihidrolipoiltranszacetiláz hiány
Autoszomális recesszív öröklődés, a betegség újszülöttkori megjelenése, mikrocefália, késleltetett pszichomotoros fejlődés, izom hipotenzió, amelyet az izomtónus növekedése követ, optikai lemez atrófia, tejsavas acidózis, a dihidrolipoiltrán-acetiláz aktivitásának csökkenése
7.5 A dihidrolipoil-dehidrogenáz hiánya
Autoszomális recesszív öröklődés, a betegség kialakulása az élet első évében, a "petyhüdt gyermek" tünetegyüttese, diszmetabolikus krízisek hányással és hasmenéssel, késleltetett pszichomotoros fejlődés, optikai lemez atrófia, tejsavas acidózis, megnövekedett szérum alanin, α- ketoglutarát, elágazó láncú α-keto savak, csökkent dihidrolipoil-dehidrogenáz aktivitás
8 A zsírsavak béta-oxidációjának hibáiból eredő betegségek
8.1 Hosszú láncú acetil-CoA dehidrogenáz hiánya
Autoszomális recesszív öröklődési mód, a betegség kialakulása az élet első hónapjaiban, metabolikus krízisek hányással és hasmenéssel, "petyhüdt gyermek" tünetei, hipoglikémia, dikarbonsav-aciduria, a hosszú szénláncú zsírsavak acetil-CoA dehidrogenázjának csökkent aktivitása
8.2 A középső szén-acetil-CoA-dehidrogenáz hiánya
Autoszomális recesszív öröklődési mód, a betegség kialakulása az újszülött korában vagy az élet első hónapjaiban, metabolikus krízisek hányással és hasmenéssel,
izomgyengeség és hipotenzió, gyakran hirtelen halál szindróma, hipoglikémia, dikarbonsav aciduria, közepesen szénláncú zsírsavak csökkent acetil-CoA dehidrogenáza
8.3. Rövid szénláncú zsírsavak acetil-CoA dehidrogenázának hiánya
Autoszomális recesszív öröklődés, a betegség kialakulásának különböző korai, csökkent testtűrés, metabolikus krízisek hányással és hasmenéssel, izomgyengeség és hipotenzió, fokozott vizeletürítés a metil-borostyánkősav, rövid szénláncú zsírsavak acetil-CoA dehidrogenázai miatt
8.4 A zsírsavak acetil-CoA dehidrogenázainak többszörös hiánya
Újszülött forma: craniofacialis dysmorphia, agydysginesia, súlyos hypoglykaemia és acidosis, rosszindulatú lefolyás, a zsírsavak összes acetil-CoA dehidrogenázjának csökkent aktivitása,
Infantilis forma:lomha gyermeki tünetegyüttes, kardiomiopátia, anyagcsere-krízisek, hipoglikémia és acidózis
8.5 A zsírsavak összes acetil-CoA dehidrogenáz aktivitásának csökkenése
Késői debütáló forma:az izomgyengeség, az anyagcsere-krízisek, a hipoglikémia és az acidózis időszakos epizódjai kevésbé hangsúlyosak, az intelligencia megmaradt,
9 .Krebs ciklusos a fermentopathia
9.1 Fumaráz-hiány
Autoszomális recesszív öröklődési mód, a betegség kialakulása újszülött vagy újszülött korában, mikrocefália, általános izomgyengeség és hipotenzió, letargia epizódok, gyorsan progresszív en-cefalopathia, rossz prognózis
9.2 Szukcinát-dehidrogenáz hiány
Ritka betegség, amelyet progresszív encephalomyopathia jellemez
9.3 Alfa-ketoglutarát dehidrogenáz hiány
Autoszomális recesszív öröklődés, újszülöttkori betegség kialakulása, mikrokefália, "petyhüdt gyermek" tünetegyüttese, letargia, tejsavas acidózis epizódok, gyorsan előrehaladó lefolyás, a Krebs-ciklus enzimtartalmának csökkenése a szövetekben
9.4. A karnitin és metabolizmusának enzimhiányos tünetei
A karnitin-palmitoil-transzferáz-1 hiánya, az autoszomális recesszív öröklődés típusa, a betegség korai kialakulása, a nem ketonémiás hipoglikémiás kóma epizódjai, a hepatomegalia, a hipertrigliceridémia és a mérsékelt hyperammoniemia, a karnitin-palmitoil-transzferáz-1 aktivitásának csökkenése a májban és a májban
9.5 Karnitin-acilkarnitin-transzlokáz hiány
A betegség korai kialakulása, szív- és érrendszeri és légzőszervi rendellenességek, a "petyhüdt gyermek" tünetei, letargia és kóma epizódok, a karnitin-észterek koncentrációjának növekedése és egy hosszú szénlánc a szabad vérben lévő karnitin csökkenése, a karnitin-acilkarnitin-transzlokáz aktivitásának csökkenése mellett
9.6 Karnitin-palmitoil-transzferáz-2 hiány
Autoszomális recesszív öröklődés, izomgyengeség, myalgia, myoglobinuria, a karnitin-palmitoil-transzferáz-2 aktivitásának csökkenése a vázizomzatban
Autoszomális recesszív öröklődési mód, myopathiás tünetek komplexe, letargia és letargia epizódok, kardiomiopátia, hipoglikémia epizódok, a karnitin szintjének csökkenése a vérszérumban és a vizelettel történő kiválasztódás növekedése.
A mitokondriális (és nem csak) genom működésében bekövetkező bizonyos változásokhoz kapcsolódó ilyen „szörnyű” kórképek listájának elemzése után bizonyos kérdések merülnek fel. Mik a mitokondriális gének termékei, és melyik szuper-mega-vitális sejtes folyamatban vesznek részt?
Mint kiderült, a fenti patológiák egy része akkor fordulhat elő, amikor a NADH dehidrogenáz komplex 7 alegységének, 2 ATP szintetáz alegységének, 3 citokróm c oxidáz alegységének és 1 alegység ubiquinol citokróm c reduktáznak (citokróm b) szintézise következhet be. , amelyek a mitokondriumok géntermékei. Ennek alapján arra lehet következtetni, hogy kulcsfontosságú szerepe van ezeknek a fehérjéknek a sejtlégzésben, a zsírsavak oxidációjában és az ATP szintézisében, az elektrontranszferben a belső MT membrán elektrontranszport rendszerében, az antioxidáns rendszer működésében stb.
Az apoptózis mechanizmusairól szóló legfrissebb adatok alapján sok tudós arra a következtetésre jutott, hogy van egy központ az apoptózis ellenőrzésére pontosan ...
A mitokondriális fehérjék szerepét az MT szintézist blokkoló antibiotikumokkal is kimutatták. Ha a szövetkultúrában lévő emberi sejteket antibiotikummal, például tetraciklinnel vagy klóramfenikollal kezeljük, akkor egy vagy két megosztás után növekedésük leáll. Ennek oka a mitokondriális fehérjeszintézis gátlása, ami hibás mitokondriumok megjelenéséhez és ennek következtében az ATP elégtelen képződéséhez vezet. Miért használhatók akkor antibiotikumok bakteriális fertőzések kezelésére? Erre a kérdésre számos válasz adható:
1. Egyes antibiotikumok (például az eritromicin) nem jutnak át az emlősök mitokondriumainak belső membránján.
2. A testünk sejtjeinek többsége nem nagyon lassan oszlik fel vagy osztódik fel, így a meglévő mitokondriumok cseréje újakkal ugyanolyan lassan következik be (sok szövetben a mitokondriumok fele körülbelül öt nap alatt vagy még hosszabb ideig cserélődik ki). Így a normális mitokondriumok száma csak akkor csökken kritikus szintre, ha a mitokondriális fehérjeszintézis blokádját sok napig fenntartják.
3. A szöveten belüli bizonyos körülmények megakadályozzák bizonyos gyógyszerek behatolását a legérzékenyebb sejtek mitokondriumaiba. Például a Ca2 + magas koncentrációja a csontvelőben egy Ca2 + -tetraciklin komplex képződéséhez vezet, amely nem képes behatolni a vérsejtek gyorsan osztódó (és ezért a legkiszolgáltatottabb) prekurzoraiba.
Ezek a tényezők lehetővé teszik a mitokondriális fehérjeszintézist gátló néhány gyógyszer alkalmazását antibiotikumként a magasabb rendű állatok kezelésében. Ezen gyógyszerek közül csak kettőnek vannak mellékhatásai: nagy dózisú kloramfenikollal történő hosszú távú kezelés a csontvelő vérképző funkciójának megzavarásához vezethet (elnyomja a vörösvérsejtek és a leukociták képződését), és a tetraciklin hosszú távú alkalmazása - a bélhám károsodásához. De mindkét esetben még nem teljesen világos, hogy ezeket a mellékhatásokat a mitokondriális biogenezis blokkolása okozza-e, vagy valamilyen más ok.
Következtetés
Az mt genom szerkezeti és funkcionális jellemzői a következők. Először azt tapasztalták, hogy az mtDNS az anyától az egész nőig terjed
leszármazottainak és lányaitól minden további nemzedéknek, de a fiak nem adják tovább a DNS-ét (anyai örökség). Anyai jellem
az mtDNS öröklődése valószínűleg két körülménynek köszönhető: vagy az apai mtDNS aránya olyan kicsi (lehet, hogy nincs
25 ezer anyai mtDNS-nél egynél több DNS-molekula), amelyek meglévő módszerekkel nem mutathatók ki, vagy a megtermékenyítés után az apai mitokondrium replikációja blokkolva van. Másodszor, a kombinációs variabilitás hiánya - az mtDNS csak az egyik szülőé, ezért a meiózisban nincsenek a nukleáris DNS-re jellemző rekombinációs események, és a nukleotidszekvencia csak a mutációk miatt változik generációról generációra. Harmadszor, az mtDNS-nek nincsenek intronjai
(nagy a valószínűsége annak, hogy egy véletlenszerű mutáció hatással lesz a DNS kódoló régiójára), a védő hisztonok és a hatékony DNS-helyreállító rendszer - mindez 10-szer nagyobb mutációs rátát határoz meg, mint a nukleáris DNS-ben. Negyedszer, ugyanazon sejt belsejében a normális és a mutáns mtDNS egyszerre létezhet együtt - a heteroplazmia jelensége (csak normális vagy csak mutáns mtDNS jelenlétét nevezzük homoplazmának). Végül mindkét láncot átírják és lefordítják az mtDNS-ben, és számos jellemzőben az mtDNS genetikai kódja eltér az univerzáltól (az UGA triptofánt, az AUA metionint, az AGA és az AGG stop
kodonok).
Ezek a tulajdonságok és az mt genom fent említett funkciói az mtDNS nukleotidszekvenciájának variábilitásának vizsgálatát felbecsülhetetlen eszközzé tették az orvosok, igazságügyi orvosok, evolúciós biológusok,
a történettudomány képviselői konkrét feladataik megoldásában.
1988 óta, amikor kiderült, hogy az mtDNS gének mutációi a mitokondriális myopathiák (JY Holt és mtsai., 1988) és Leber örökletes optikai neuropátia (DC Wallace, 1988) mögött állnak, a mutációk további szisztematikus azonosítása az emberi mt genomban a mitokondriális betegségek (MB) fogalmának kialakulásához vezetett. Jelenleg az mtDNS kóros mutációit fedezik fel a mitokondriális gének minden típusában.
Bibliográfia
1. Szkulacsev, mitokondrium és oxigén, Soros. művelt. zhurn.
2. A biokémia alapjai: Három kötetben M.: Mir ,.
3. Nicholes D. G. Bioenergetika, An Introd. a Chemiosm-hoz. Th., Acad. Press, 1982.
4. Stryer L. Biokémia, 2. kiadás San Fransisco, Freeman, 1981.
5. Biológiai membránok szkulacsevje. M., 1989.
6., Chentsov reticulum: felépítés és néhány funkció // A tudomány eredményei. A biológia általános problémái. 1989
7. Centsov-citológia. M.: A Moszkvai Állami Egyetem kiadója, 1995
8. , A mitokondriális genom kompetencia területe // Vestn. RAMS, 2001. 10. szám, 31–43.
9. Holt I. J, Harding A. E., Morgan-Hughes I. A. Az izom mitokondriális DNS törlése mitokondriális miopátiában szenvedő betegeknél. Nature, 331, 717-719 (1988).
10. satöbbi.Emberi genom és hajlamosító gének. SPb., 2000
11. , Mitokondriális genom. Novoszibirszk, 1990.
12. // Soros. művelt. zhurn. 1999. 10. sz. S.11-17.
13. A szimbiózis szerepe a sejtek evolúciójában. M., 1983.
14. // Soros. művelt. zhurn. 1998. 8. sz. S.2-7.
15. // Soros. művelt. zhurn. 2000. 1. sz. S.32-36.
Kijevi Nemzeti Egyetem. Tarasz Sevcsenko
Biológiai Tanszék
absztrakt
a témán:
"Az anyai genom szerepe az utódok fejlődésében"
tól tőlpuffanásenta IVtanfolyam
biokémiai Tanszék
Frolova Artem
Kijev 2004
Terv:
Bevezetés................................................. ..............................egy
A mitokondriumok eredetének szimbiotikus elmélete ... 2
A sejtmag szerepe a mitokondriális biogenezisben ................................... 5
A mitokondriumok szállítási rendszerei ............................................... ...... 7
A mitokondriális genomok mérete és alakja .................. 10
A mitokondriális genom működése ............... 14
Saját genetikai rendszer fontossága a mitokondriumok számára ........................................... ................................... 19
Citoplazmatikus öröklés .............................. 20
Történelmileg az első ilyen jellegű vizsgálatot mitokondriális DNS felhasználásával végezték. A tudósok mintát vettek Afrika, Ázsia, Európa, Amerika őslakosaiból, és ebben az első kicsi mintában összehasonlították a különböző egyedek mitokondriális DNS-ét egymással. Megállapították, hogy a mitokondriális DNS sokfélesége Afrikában a legmagasabb. És mivel ismert, hogy a mutációs események megváltoztathatják a mitokondriális DNS típusát, és az is ismert, hogy miként változhat, ezért elmondhatjuk, hogy mely típusú emberekből származhatnak mutációsan. Az összes emberben, akinek DNS-tesztet végeztek, az afrikaiaknál sokkal nagyobb volt a változatosság. Más kontinenseken a mitokondriális DNS típusai kevésbé változatosak voltak. Ez azt jelenti, hogy az afrikaiaknak több ideje volt felhalmozni ezeket a változásokat. Több idejük volt a biológiai evolúcióra, ha Afrikában találhatók olyan ősi DNS-maradványok, amelyek nem jellemzőek az európai emberi mutációkra.
Vitatható, hogy a mitokondriális DNS genetikusok képesek voltak igazolni a nők eredetét Afrikában. Tanulmányozták az Y kromoszómákat is. Kiderült, hogy férfiak is Afrikából származnak.
A mitokondriális DNS kutatásának köszönhetően nem csak azt lehet megállapítani, hogy egy személy Afrikából származik, hanem meghatározhatja származásának idejét is. Az emberiség mitokondriális elődjének megjelenési idejét a csimpánzok és a modern emberek mitokondriális DNS-ének összehasonlító vizsgálatával állapították meg. Ismerve a mutációs divergencia mértékét - 2-4% / millió év - meg lehet határozni két ág, a csimpánz és a modern ember szétválásának idejét. Ez körülbelül 5-7 millió évvel ezelőtt történt. Ebben az esetben a mutációs divergencia mértékét állandónak tekintjük.
Mitokondriális Éva
Amikor az emberek mitokondriális Éváról beszélnek, akkor nem egyénre gondolnak. Beszélnek a hasonló tulajdonságokkal rendelkező egyének egész populációjának evolúció útján történő megjelenéséről. Úgy gondolják, hogy a mitokondriális Éva abban az időszakban élt, amikor őseink száma hirtelen, mintegy tízezer egyedre csökkent.
A versenyek eredete
A különböző populációk mitokondriális DNS-ét tanulmányozva a genetikusok azt sugallták, hogy még az Afrika elhagyása előtt az őspopulációt három csoportra osztották, amelyek három modern fajt eredményeztek - afrikai, kaukázusi és mongoloid. Úgy gondolják, hogy ez körülbelül 60 - 70 ezer évvel ezelőtt történt.
A nem standard emberek és a modern emberek mitokondriális DNS-ének összehasonlítása
Az emberek eredetéről további információkat kaptak a neandervölgyi és a modern emberek mitokondriális DNS-ének genetikai szövegeinek összehasonlításával. A tudósoknak sikerült elolvasniuk két neandervölgyi csontmaradványok mitokondriális DNS-ének genetikai szövegeit. Az első neandervölgyi ember csontjait a németországi Feldhover-barlangban találták meg. Kicsivel később egy neandervölgyi gyermek mitokondriális DNS-ének genetikai szövegét olvasták fel, amelyet Észak-Kaukázusban találtak a Mezhmayskaya-barlangban. A modern emberek és a neandervölgyiek mitokondriális DNS-ét összehasonlítva nagyon nagy különbségeket találtak. Ha egy darab DNS-t veszünk, akkor a 370 nukleotidból 27. különbözik, és ha összehasonlítjuk egy modern ember genetikai szövegét, mitokondriális DNS-ét, akkor csak nyolc nukleotid különbözik egymástól. Úgy gondolják, hogy a neandervölgyi és a modern ember teljesen különálló ág, mindegyikük evolúciója egymástól függetlenül zajlott.
A neandervölgyi és a modern emberek mitokondriális DNS-ének genetikai szövegében mutatkozó különbségek tanulmányozása során meghatározták e két ág elkülönülésének dátumát. Ez körülbelül 500 ezer évvel ezelőtt történt, és körülbelül 300 ezer évvel ezelőtt történt meg végső elválásuk. Úgy gondolják, hogy a neandervölgyiek Európában és Ázsiában telepedtek le, és egy modern ember elűzte őket, aki 200 ezer évvel később hagyta el Afrikát. Végül körülbelül 28 - 35 ezer évvel ezelőtt a neandervölgyiek kihaltak. Hogy ez miért történt, általában még nem világos. Talán nem tudták elviselni a versenyt egy modern típusú emberrel, vagy ennek más oka is lehet.
Az evolúció során a "sejt energiaállomásaiban" megmaradó gének segítenek elkerülni a menedzsment problémáit: ha valami eltörik a mitokondriumokban, akkor azt maga is meg tudja javítani, anélkül, hogy a "központ" engedélyére várna.
Sejtjeink speciális mitokondrium nevű organellák segítségével kapják az energiát, amelyeket gyakran a sejt energiaállomásainak neveznek. Külsőleg kettős falú ciszternáknak tűnnek, a belső fal pedig nagyon egyenetlen, számos erős invázióval.
Egy sejt maggal (kék színű) és mitokondriummal (piros színű). (Fotó: NICHD / Flickr.com.)
Szekcionált mitokondriumok; a belső membrán kinövései hosszanti belső csíkokként láthatók. (Fotó: Visuals Unlimited / Corbis.)
A mitokondriumokban hatalmas számú biokémiai reakció megy végbe, amelyek során az "élelmiszer" molekulák fokozatosan oxidálódnak és szétesnek, kémiai kötéseik energiáját a sejt számára megfelelő formában tárolják. Ezenkívül ezeknek az "erőműveknek" megvan a saját génekkel rendelkező DNS-je, amelyet saját molekuláris gépeik szolgálnak, amelyek az RNS-szintézist biztosítják a későbbi fehérjeszintézissel.
Úgy gondolják, hogy a mitokondriumok a nagyon távoli múltban független baktériumok voltak, amelyeket néhány más egysejtű lény (nagy valószínűséggel archaea) fogyasztott. De egy nap a „ragadozók” hirtelen abbahagyták a lenyelt proto-mitokondrium emésztését, és magukban tartották őket. Megkezdődött a szimbiontusok hosszú őrlése egymással; Ennek eredményeként a lenyeltek szerkezete sokkal egyszerűbbé vált és intracelluláris organellákká váltak, és "gazdáik" a hatékonyabb energia miatt tovább fejlődhettek az élet egyre összetettebb formáivá, a növényekig és az állatokig.
Azt a tényt, hogy a mitokondriumok egykor függetlenek voltak, genetikai apparátusuk maradványai bizonyítják. Természetesen, ha minden készen él benne, akkor eltűnik az igény a saját génjeinek tárolására: az emberi sejtekben található modern mitokondriumok DNS-je csak 37 gént tartalmaz - 20-25 ezerrel szemben a nukleáris DNS-ben. A mitokondriális gének közül sok az evolúció millió éve alatt beköltözött a sejtmagba: az általuk kódolt fehérjéket a citoplazmában szintetizálják, majd a mitokondriumba szállítják. Azonban azonnal felmerül a kérdés: miért maradt 37 gén mégis ott, ahol volt?
Megismételjük, hogy a mitokondriumok minden eukarióta organizmusban megtalálhatók, vagyis állatokban, növényekben, gombákban és protozoákban. Ian Johnston ( Iain johston) a Birminghami Egyetemen és Ben Williams ( Ben P. Williams) a Whitehead Intézet több mint 2000 mitokondriális genomot elemzett, amelyek különböző eukariótákból származnak. Egy speciális matematikai modell segítségével a kutatók meg tudták érteni, hogy az evolúció során melyik gén közül valószínűbb, hogy a mitokondriumokban maradnak.
A mágneses mezők olyan fizikai és külső erők, amelyek a sejtbiológiában többféle reakciót váltanak ki, amelyek magukban foglalják az RNS és a DNS információcseréjének változásait, valamint számos genetikai tényezőt. Amikor változások következnek be a bolygó mágneses mezőjében, az elektromágnesesség (EMF) szintje megváltozik, közvetlenül megváltoztatva a sejtes folyamatokat, a genetikai expressziót és a vérplazmát. A fehérjék funkciói az emberi testben, valamint a vérplazmában összefüggenek az EMF mező tulajdonságait és hatását. A fehérjék számos funkciót látnak el az élő organizmusokban, többek között metabolikus reakciók katalizátorként működnek, replikálják a DNS-t, kiváltják a kórokozókra adott reakciókat, és molekulákat mozgatnak egyik helyről a másikra. A vérplazma fehérje raktárként működik a szervezetben, véd a fertőzések és a betegségek ellen, és létfontosságú szerepet játszik a DNS szintéziséhez szükséges fehérjék biztosításában. Vérünk és vérplazmánk minősége az, ami parancsokat ad a fehérjék teljes készletének, genetikai anyagunk révén kifejezve az összes sejtben és szövetben. Ez azt jelenti, hogy a vér közvetlenül kölcsönhatásba lép a testtel a DNS-nkben kódolt fehérjék révén. Ez a fehérjeszintézis kapcsolat a DNS, az RNS és a sejt mitokondrium között megváltozik a mágneses mező változásai következtében.
Ezenkívül vörösvértestjeink tartalmaznak hemoglobint, amely fehérje a vasmag állapotához és a föld mágnesességéhez kapcsolódó négy vasatomon alapul. A vérben lévő hemoglobin oxigént szállít a tüdőből a test többi részébe, ahol oxigén szabadul fel a tápanyagok elégetéséhez. Ez energiát biztosít testünk munkájához, az energia-anyagcserének nevezett folyamatban. Ez azért fontos, mert a vérünkben bekövetkező változások közvetlenül kapcsolódnak a testünkben és az elménkben zajló anyagcsere folyamatának energiájához. Ez még nyilvánvalóbbá válik, amikor elkezdünk figyelni ezekre a jelekre, amelyek megváltoztatják az energiafogyasztást és az energiaforrások felhasználását a bolygón. Visszatérés jogos tulajdonosukhoz egyben a testünk mikrokozmoszában bekövetkező energia-anyagcsere megváltoztatását is jelenti, tükrözve a Föld makrokozmoszában bekövetkezett változásokat. Ez egy fontos szakasz a vezérlők fogyasztási modellezésének végén, annak érdekében, hogy a megőrzési elvek egyensúlyban legyenek a belső egyensúly megtalálása érdekében, és ezért elérjék az energiamérleget ezeken a rendszereken belül. E változások fontos része a mitokondrium magasabb funkcióinak rejtélyében rejlik.
Anya mitokondriális DNS-je
Ha összehasonlítjuk a teremtésünkben rejlő nemi alapelvet, és azt, hogy Anyánk-elvünk mágneses mezőn keresztül energiás egyensúlyt juttat a Föld magjába, a következő lépés a mitokondriális DNS helyreállítása. A mitokondriális DNS a mitokondriumokban elhelyezkedő DNS, a sejteken belüli struktúrák, amelyek az élelmiszerből származó kémiai energiát a sejtek által felhasználható formává alakítják, adenozin-trifoszfát (ATP). Az ATP a test sejtjei és szövetei által vezetett fény koefficienst méri, és közvetlenül kapcsolódik a spirituális tudat megtestesüléséhez, amely energia és fontos az energia-anyagcseréhez.
 A mitokondriális DNS csak egy kis része a sejtnek a DNS-ben; a DNS legnagyobb része a sejtmagban található. A Földön a legtöbb faj, beleértve az embereket is, kizárólag az édesanyjától örökli a mitokondriális DNS-t. A mitokondriumoknak saját genetikai anyaguk és mechanizmusaik vannak a saját RNS és új fehérjék előállításához. Ezt a folyamatot nevezzük fehérje bioszintézisnek. A fehérje bioszintézis azokra a folyamatokra utal, amelyek során a biológiai sejtek új fehérjeszetteket hoznak létre.
A mitokondriális DNS csak egy kis része a sejtnek a DNS-ben; a DNS legnagyobb része a sejtmagban található. A Földön a legtöbb faj, beleértve az embereket is, kizárólag az édesanyjától örökli a mitokondriális DNS-t. A mitokondriumoknak saját genetikai anyaguk és mechanizmusaik vannak a saját RNS és új fehérjék előállításához. Ezt a folyamatot nevezzük fehérje bioszintézisnek. A fehérje bioszintézis azokra a folyamatokra utal, amelyek során a biológiai sejtek új fehérjeszetteket hoznak létre.
Megfelelően működő mitokondriális DNS nélkül az emberiség nem képes hatékonyan előállítani új fehérjéket a DNS-szintézishez, valamint fenntartani az ATP szintjét, amely szükséges a sejtben való fény előállításához, hogy megtestesítse lelki tudatunkat. Így a mitokondriális DNS károsodása miatt az emberiség rendkívül rabja annak, hogy mindent elfogyasszon a külvilágban, hogy kitöltse a sejtjeinkben lévő üreg energiáját. (A függőségeket lásd: Negatív idegen program idegen idegen telepítései).
A közelmúlt történelmünkben semmi mást nem ismerve és az emlékek törlése, az emberiség nincs tudatában annak, hogy jelentősen diszfunkcionális mitokondrióval léteztünk.
Ez közvetlen következménye az Anya DNS-ének, mágneses alapelveinek, protonszerkezetének a Földből történő kinyerésének, valamint a "Sötét Anya" szintetikus idegen változatának jelenlétének, amelyet a bolygó építészetébe helyeztek funkcióinak utánzása céljából. Az emberiség létezett egy bolygón, valódi Anyaelv nélkül, és ezt nyilvánvalóan feljegyezték mitokondriális DNS sejtjeinkben. Ezt sokszor úgy írták le, hogy a magnetoszféra és a mágneses tér manipulálása révén a Negatív Idegen Program behatol a Bolygó Logoi-ba.
Christa
A belső mitokondriális membrán számos cristaában oszlik meg, amelyek megnövelik a belső mitokondriális membrán felületét, növelve annak képességét ATP előállítására. Ez a mitokondrium régiója megfelelő működés esetén növeli az ATP energiáját és fényt generál a test sejtjeiben és szöveteiben. A mitokondriumban a cristae magasabb funkciója a Felemelkedés csoportokban aktiválódik, ebben a ciklusban kezdődik. A "crista" nevet tudományos felfedezés eredményeként kapták, mivel közvetlenül kapcsolódik a kristálygén aktiválódásához.
Az ösztrogén receptorok megváltoztatása
Az anyai mitokondriális DNS-nek és a mágneses eltolódásoknak számos olyan tényezője van, amely kiigazítja és tüneteket okoz a nő reproduktív ciklusaiban. Az ösztrogén hormonok aktiválják az ösztrogén receptorokat, amelyek olyan fehérjék, amelyek belépnek a sejtekbe és kötődnek a DNS-hez, megváltoztatva a genetikai kifejeződést. A sejtek egymással kommunikálhatnak olyan molekulák felszabadításával, amelyek továbbítják a jeleket más befogadó sejtekhez. Az ösztrogént olyan szövetek választják ki, mint a petefészkek és a méhlepény, átjutva a befogadó sejtek sejtmembránjain, és kötődik a sejtekben található ösztrogén receptorokhoz. Az ösztrogén receptorok szabályozzák az üzenetek továbbítását a DNS és az RNS között. Így manapság sok nő szokatlan, furcsa menstruációs ciklust vesz észre, amelyet az ösztrogén dominancia okoz. Az ösztrogénszint változása férfiaknál és nőknél egyaránt bekövetkezik, ezért figyeljen a testére, szükség lehet ezeknek a változásoknak a támogatására. A máj és a méregtelenítés gondozása, a cukorbevitel és a hormonokat stimuláló és növelő ételek megszüntetése, a belekben és a testben a baktériumok egyensúlyának figyelemmel kísérése - ez hasznos az ösztrogén egyensúly fenntartásához.
A mitokondriális betegség elvezeti az energiát
A mitokondriális betegségek a DNS-szekvenciában megjelenő genetikai mutációkból származnak. A bolygón elhelyezett mesterséges építészet, például az idegen gépezet, amely genetikai módosításokat kíván létrehozni az Anya DNS-jének bitorlásához, amely mutációkként és a DNS mindenféle károsodásaként nyilvánul meg. A mitokondriális betegségeket az energia elzáródása jellemzi a testben, annak a ténynek köszönhető, hogy a betegség felhalmozódik, öröklődő vérvonalakban örökli az anyai genetikát.
A mitokondrium elengedhetetlen a sejtek mindennapi működéséhez és az energia-anyagcseréhez, ami a lélek lelki fejlődéséhez és a Túllélek (monád) megtestesüléséhez is vezet. A mitokondriális betegség csökkenti a test és az elme számára rendelkezésre álló hatékony energiatermelést, és megállítja az emberi fejlődés és a spirituális növekedést. Így a test gyorsabban öregszik, és megnő a betegség kockázata; a személyes energia inaktiválódik és így kimerül. Ez nagymértékben korlátozza az agy fejlődéséhez és az összes neurológiai rendszer működéséhez rendelkezésre álló hasznosítható energia mennyiségét. Az agy és a neurológiai fejlődés energiakészleteinek kimerülése hozzájárul az autizmus, a neurodegeneráció és az agyműködés egyéb hiányosságainak spektrumához. A mitokondriális gének hibái több száz "klinikai" betegséggel társulnak a vérben, az agyban és a neurológiai rendellenességekben.
A bolygó test vérének, agyának és neurológiai funkcióinak funkcióit egyenlővé teszik a ley vonalak, csakraközpontok és Csillagkapu rendszerek felépítésével, amelyek az energia (vér) áramlását irányítják, hogy kialakítsák a tudat testét, az úgynevezett 12 bolygó templom fatábláját. A vér, az agy és az emberi test neurológiai funkciói azonosak az Emberi Templom ugyanazon 12. rácsával. Miután a Templom és a DNS-létesítmények megsérültek vagy megváltoztak, a vér, az agy és az idegrendszer megsérül. Ha vérünk, agyunk és idegrendszerünk eltömődött vagy megsérült, nem tudjuk lefordítani a nyelvet, tartani a kapcsolatot, többdimenziós fénytesteket építeni a legmagasabb bölcsesség (Sophia) megszerzésére. Sokféle nyelvünk, beleértve a DNS nyelvünket is, összekeverik és összekeverik azokat, akik a Föld rabszolgaságára és megkeményítésére törekedtek.
Mint tudjuk, a kinetikus vagy más külső energiák többségét az uralkodó elit aktívan ellenőrzi, hogy elnyomja az emberi fejlődést, és korlátozza az erőforrások méltányos felhasználásának vagy tisztességes cseréjének lehetőségeit a Föld lakossága számára. Y stratégiája az összes energia és energiaforrás kezelése (akár a DNS és a lélek felett is), így létrehozva egy uralkodó osztályt és egy rabszolgák vagy rabszolgák osztályát. Az Orion-csoport megosztása és meghódítása módszerével sokkal könnyebb kezelni a félelem által traumatizált, tudatlan és szegénységben élő lakosságot.
Fordítás: Oreanda Web
Fő cikk: Mitokondriális DNS
A mátrixban elhelyezkedő mitokondriális DNS egy zárt kör alakú kettős szálú molekula, az emberi sejtekben 16569 bázispár nagyságú, ami körülbelül 10-szer kisebb, mint a magban elhelyezkedő DNS. Általában a mitokondriális DNS 2 rRNS-t, 22 tRNS-t és 13 légzési láncenzim alegységet kódol, ami nem több, mint a benne található fehérjék fele. Különösen a mitokondriális genom irányítása alatt az ATP-szintetáz hét alegysége, a citokróm-oxidáz három alegysége és az ubiquinol-citokróm egy alegysége tól től-reduktázok. Ebben az esetben az összes fehérje, egy, két riboszomális és hat transzport RNS kivételével, átíródik a nehezebb (külső) DNS-szálból, 14 másik tRNS és egy fehérje pedig a könnyebb (belső) szálból.
Ennek fényében a növényi mitokondrium genomja sokkal nagyobb, és elérheti a 370 000 nukleotidpárot, ami körülbelül 20-szor nagyobb, mint a humán fent leírt mitokondriális genom. A gének száma itt szintén körülbelül hétszer nagyobb, ami a növényi mitokondriumokban további elektrontranszport-utak megjelenésével jár, amelyek nem kapcsolódnak ATP-szintézishez.
A mitokondriális DNS interfázisban replikálódik, amely részben szinkronban van a sejtmag replikációjával. A sejtciklus során a mitokondriumok szűküléssel kettéválnak, amelynek kialakulása a belső mitokondriális membrán gyűrű alakú hornyával kezdődik. A mitokondriális genom nukleotidszekvenciájának részletes vizsgálata lehetővé tette annak megállapítását, hogy az állatok és gombák mitokondriumaiban az univerzális genetikai kódtól való eltérések gyakoriak. Tehát az emberi mitokondriumokban a standard kódban szereplő izoleucin helyett a TAT kodon a metionin aminosavat kódolja, a általában arginint kódoló TCT és TCC kodonok stopkodonok, az AST kodon pedig, amely a standard kód stopkodonja, a metionin aminosavat kódolja. Ami a növényi mitokondriumokat illeti, úgy tűnik, hogy univerzális genetikai kódot használnak. A mitokondriumok másik jellemzője a tRNS kodonok felismerése, amely abban áll, hogy egy ilyen molekula egyszerre nem egy, hanem három vagy négy kodont képes felismerni. Ez a tulajdonság csökkenti a kodon harmadik nukleotidjának jelentőségét, és oda vezet, hogy a mitokondriumoknak kisebb tRNS-típusokra van szükségük. Ebben az esetben csak 22 különböző tRNS elegendő.
Saját genetikai apparátusa birtokában a mitokondrium saját fehérjeszintetizáló rendszerrel is rendelkezik, amelynek egyik jellemzője az állatok és gombák sejtjeiben nagyon kicsi riboszóma, amelyet 55S szedimentációs együttható jellemez, ami még alacsonyabb, mint a prokarióta típusú 70S riboszómáké. Ebben az esetben két nagy riboszomális RNS is kisebb, mint a prokariótákban, és a kis rRNS teljesen hiányzik. A növényi mitokondriumokban éppen ellenkezőleg, a riboszómák méretükben és felépítésükben jobban hasonlítanak a prokarióta sejtekhez.
Mitokondriális fehérjék [szerkesztés | forrás szerkesztése]
A mitokondriális mRNS-ből transzlált és a nagy enzimatikus komplexek alegységeit alkotó fehérjék száma korlátozott. A fehérjék jelentős része a magban kódolódik, és szintetizálódik a citoplazmatikus 80S riboszómákon. Különösen így alakulnak ki egyes fehérjék - elektronhordozók, mitokondriális transzlokák, a fehérjék mitokondriumba történő transzportjának összetevői, valamint a mitokondriális DNS transzkripciójához, transzlációjához és replikációjához szükséges tényezők. Ezenkívül az ilyen fehérjék N-terminálisán speciális szignálpeptidek találhatók, amelyek mérete 12 és 80 aminosav közötti marad. Ezek a területek amfifil fürtöket képeznek, specifikus kapcsolatot biztosítanak a fehérjéknek a külső membránon elhelyezkedő mitokondriális felismerő receptorok kötő doménjeivel. Ezeket a fehérjéket a chaperone fehérjékkel (különösen a hsp70-gyel) kapcsolatban részben kibontott állapotban szállítják a külső mitokondriális membránra. Miután a külső és a belső membránon átjutnak az érintkezésük helyén, a mitokondriumba belépő fehérjék ismét kötődnek a chaperonokhoz, de saját mitokondriális eredetűek, amelyek felveszik a membránon átjutó fehérjét, elősegítik annak visszahúzódását a mitokondriumba, és szabályozzák a polipeptidlánc helyes hajtogatását is. A legtöbb chaperon rendelkezik ATPáz aktivitással, ennek eredményeként a fehérjék mitokondriumba történő transzportja és funkcionálisan aktív formáik kialakulása energiafüggő folyamat.