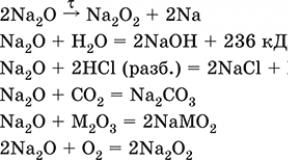Kalcium-karbonát színes lángok. Általános és szervetlen kémia kézikönyve. Lime tej hozzáadása
Nátrium - eleme a 3. harmadban és az IA-csoport a periódusos rendszer, sorszám 11. Az elektronikus képletű atom [10 NE] 3S 1, oxidációs foka + i és 0. Ez a kis electronegitability (0,93), csak a fémes (Fő) tulajdonságok. Számos sót és bináris vegyületet (kationként). Szinte minden nátriumsó a vízben jól oldódik.
A természetben - ötödik Kémiai prevalenciával az elemet (a fémek közül a fémek) csak a kapcsolatok formájában találhatók. Minden szervezet számára létfontosságú elem.
Nátrium, nátrium-kation és vegyületei festék a gázégő lángját fényes sárga színben ( minőségérzékelés).
Nátrium Na. Ezüstfehér fém, fény, puha (késsel vágva), alacsony olvadás. Tárolja a nátriumot kerozinban. A higany formák folyékony ötvözet - Amalgám (legfeljebb 0,2% NA).
Nagyon reakcióképes, a nedves levegő nátrium lassan borított hidroxiddal film és elveszti fényét (dim):
A nátrium kémiailag aktív, erős redukálószer. A levegőben lévő lángok mérsékelt melegítéssel (\u003e 250 ° C), nem fémekkel reagálnak:
2na + o 2 \u003d Na 2O 2 2Na + h 2 \u003d 2nah
2NA + CL 2 \u003d 2NACL 2NA + S \u003d NA 2 S
6na + n 2 \u003d 2NA 3N 2NA + 2C \u003d Na 2 C 2
Nagyon erőszakosan és nagyokkal exo- A nátrium-hatás vízzel reagál:
2NA + 2H 2O \u003d 2NOH + H2 ^ + 368 kJ
A hőt a reakció, nátrium-darabokat olvadt golyó, amely elkezd mozogni véletlenszerűen felszabadulása miatt a H 2. A reakciót éles kattintások kíséri a csörgőgáz (H2 + O 2) robbanásai miatt. Az oldatot fenolfthalénnel festjük a málna színben (lúgos közeg).
A nátrium-stresszsorban a hidrogén bal oldali, hígított HCI és H2S04 savak, hidrogén elmozdul (H20 és H + miatt).
Megszerzés Nátrium az iparban:
(Lásd még a NaOH átvételét is).
A nátriumot Na 2O 2, NaOH, NaH, valamint szerves szintézis előállítására használják. A megolvasztott nátrium szolgál hűtőközeg atomreaktorok, és gáznemű - alkalmazzák töltőanyagként sárga-szoros lámpák kültéri világítás.
Nátrium-oxid Na 2 O. Alap-oxid. Fehér, ionos szerkezet (Na +) 2 O 2-. Termikusan stabil, kalcinálással lassan bomlik, a Na gőz felesleges nyomása alatt olvad. Érzékeny a nedvességre és a szén-dioxidra a levegőben. Energetikusan reagál vízzel (erősen lúgos oldat képződik), savak, savak és amfoteroxidok, oxigén (nyomás alatt). Nátriumsók szintetizálására szolgál. Nem képződik a nátrium levegőben történő égetésekor.
A legfontosabb reakciók egyenletei:

Szerzés: Hőbomlás Na 2 O 2 (lásd), valamint Na és NaOH, Na és NaOH 2O 2:
2NA + 2NAOH \u003d 2NA O + H2 (600 ° C)
2NA + Na 2O 2 \u003d 2NA AO (130-200 ° C)
Nátrium-peroxid Na 2 o 2. Bináris kapcsolat. Fehér, higroszkópos. Ionos szerkezetű (Na +) 2 O 2 2-. Amikor fűtött bomlik, az O 2 túlnyomás alatt olvad. Felszívja a szén-dioxidot a levegőből. Teljesen bomlik vízzel, savakkal (O 2 szelekció, ha forrásban van - Minőségreakció peroxidokonként). Erős oxidálószer, gyenge redukálószer. Az oxigén regenerálására szolgálsz. A legfontosabb reakciók egyenletei:
2NA 2O 2 \u003d 2Na 2O + O 2 (400-675 ° C, vákuum)
NA 2O 2 + 2N 2 O \u003d H 2O 2 + 2NAOH (hidegen)
2NA 2O 2 + 2N 2 O \u003d O 2 ^ + 4naOH (forrás)
NA 2O 2 + 2NCL (RSC) \u003d 2NACL + H 2O 2 (hideg)
2NA 2O 2 + 4nCl (RSC) \u003d 4ncl + 2n 2 o + o 2 ^ (forrás)
2NA 2O 2 + 2CO 2 \u003d Na 2 CO 3 + O 2
NA 2O 2 + CO \u003d NA 2 CO 3
NA 2O 2 + 4H + 2I - \u003d I 2 V + 2H 2O + 2NA +
5NA 2O 2 + 16H + + 2MNO 4 - \u003d 5O 2 ^ + 2MN 2+ + 8H 2O + 10NA +
3NA 2O 2 + 2 3- \u003d 2CRO 2 4- + 8OH - + 2H 2O + 6NA + (80 ° C)
Szerzés: Égő na a levegőben.
Nátrium-hidroxid NaOH. Alapvető hidroxid, alkáli, műszaki név nátrium-hidroxid. Fehér kristályok ionos szerkezetű (Na +) (OH -). A légtelenítő nedvesség és a szén-dioxid vakok (NAHCO 3 képződése). Megolvad és bomlás nélkül elolvad. Súlyos bőrt és szemurítást okoz.
Nos oldható vízben (a exo- hatás, +56 kJ). Reagál sav-oxidokkal, savszegélyszel, savas funkciót okoz az amfoteroxidokban és a hidroxidokban:

NaOH (RSS) + H 3 PO 4 (Conc.) \u003d NAH 2 PO 4 + H 2 O
2naOH (SPL.) + H 3 PO 4 (RSC) \u003d Na 2 HPO 4 + 2H 2O
3naOH (Conc.) + H 3 PO 4 (RSC) \u003d Na 3 PO 4 + 3H 2O
2NAOH (T) + M 2O 3 \u003d 2NAMO 2 + H20 (1000 ° C, M \u003d AL, CR)
2naOH (conc.) + 3H 2O + AI 2O 3 \u003d 2NA (forrás)
2NAOH (T) + M (OH) 2 \u003d Na 2 MO 2 + 2H 2O (500 ° C, M \u003d Be, Zn)
2naOH (conc.) + Zn (OH) 2 \u003d Na 2
Kicsapódik az oldhatatlan hidroxidokat:
2NAOH + MCI 2 \u003d 2NACL + M (OH) 2 V (M \u003d MG, CU)
Diameses halogének és kén:
2naOH (conc., Ház) + E 2 \u003d Nae + Naeo + H 2 O (E \u003d Cl, Br)
6naOH (Split, hegyek) + 3s \u003d 2Na 2 S + Na 2 SO 3 + 3H 2O
Elektrolízisnek van kitéve az olvadékban:
A NaOH-oldat hadtestje az üveg (NASIO 3 képződik), korrodálja az alumínium felületet (Na és H2 képződik).
Megszerzés NaOH B. ipar:
a) elektrolízis NaCl oldat egy inert katódon:
b) NaCl-oldat elektrolízise higany katódon (amalgamy módszer):

(A gyakori higany visszatért az elektrolizátorba).
A kausztikus Natra a vegyipar legfontosabb nyersanyagai. Nátriumsók, cellulóz, szappan, festékek és mesterséges szálak előállítására használják; gázszárítóként; Reagens a másodlagos nyersanyagokból és tisztító ónból és cinkből; Alumínium ércek (bauxit) feldolgozásakor.
Kálium - az időszakos rendszer 4. periódusának és IA-csoportjának eleme, 19. sorszáma. Az atom elektronikus képlete [18 AR] 4S 1, az oxidációs fok + I és 0. Kis elektronegativitással rendelkezik (0,91), ez a fém (Fő) tulajdonságok. Számos sót és bináris vegyületet (kationként). Szinte minden káliumsó a vízben jól oldódik.
A természetben - kilencedik Kémiai prevalenciával az elem (a fémek hatodik) csak a kapcsolatok formájában van. Minden szervezet számára létfontosságú elem.
A talajban lévő kálium hiánya a potash trágyák - CL-klorid, K 2 SO 4 szulfát és növények hamu bevezetésével pótolódik.
Kálium, kálium kálium és csatlakozásai a lila színű gázégő lángját festik ( minőségérzékelés).
Kálium NAK NEK. Ezüstfehér fém, könnyű, nagyon puha, alacsony olvadás. A káliumot a kerozin réteg alatt tárolja. A higany formák folyékony ötvözet - amalgám.
A kémiai tulajdonságok szerint úgy néz ki, mint a nátrium, de még inkább reaktívabb. A nedves levegő-fúzerekben, amely a hidroxidfóliát lefedi.
A kálium erős rehabilitációs tulajdonságokkal rendelkezik. Aktívan éget a levegőben KO 2-be, reagál a hidrogénnel (KH termék), klór (KCL), szürke (KCL).
Erőteljesen és magas exo- A káliumhatás bomlik a vizet:
2K + 2H 2O \u003d 2koh + h 2 ^ + 392 kJ,
a kiadott hidrogén azonnal lángolt.
A kálium-stresszsorban sokkal a hidrogén bal oldalán maradt, a hígított sósavakból és a H2S04-ről a hidrogénből (H20 és H +) kiszorulnak, míg a kénsav részlegesen visszaáll az SO 2-re.
Megszerzés kálium B. ipar Egyenlően a nátrium eléréséhez.
Kálium szintetizálására használatos vegyületei (KO 2, KH, sók), mint egy olvadék (a keverékben a Na) -, mint a hűtőközeg a nukleáris reaktorok.
Kálium-hidroxid Con. Fő hidroxid, Pitch, Műszaki név Szekrény. Fehér, ionos szerkezete + IT -. Megolvad és bomlás nélkül elolvad. Villog a levegőben, elnyeli a szén-dioxidot (CNSO 3 képződik). Súlyos bőrt és szemurítást okoz.
Nos, vízben oldódik (magas exo- hatás), erősen magas lúgos környezetet teremt megoldásban. Sósavval semlegesítve, savas oxidokkal, amfoter hidroxidokkal és oxidokkal reagál. A koncentrált oldat hadtest az üveg (K 2 SiO 3 képződik).
A Con Industries legfontosabb reakciói és módszerei hasonlóak a tulajdonságokhoz és a NaOH megszerzéséhez.
Szappan előállításánál használják gázok adszorbensként, dehidratálószer, oldhatatlan fémhidroxidok kicsapódása.
5.3. Kalcium
Kalcium - Az időszakos rendszer 4. periódusának és IIa-csoportjának eleme, szekvencia 2o. Az atom elektronikus képlete [18 AR] 4S 2, a + II és a 0 oxidációs fokok alkáliföldfémekre vonatkoznak.
Alacsony elektronikus (1,04), manifesztálja a fémes (fő) tulajdonságokat. Számos sót és bináris vegyületet (kationként). Sok kalciumsó kicsi a vízben.
A természetben - hatodik A kémiai prevalenciával egy elem (harmadik a fémek között) a kapcsolódó formában van. Minden szervezet számára létfontosságú elem.
A kalcium hiánya a talajban tele van lime műtrágyák (CACO 3, CAO, CAACN 2 kalcium-cianamid stb.).
A kalcium, a kalcium kation és annak vegyületei színezik a gázégő lángját sötét narancssárga színre ( minőségérzékelés).
Kalcium SA. Ezüstös és fehér fém, puha, műanyag. A nedves levegőben a Cao és az SA (OH) 2-ből származó filmben van.
Nagyon reaktív; Gyúlékony levegőben fűtött, hidrogénnel, klórral, szürke és grafitával reagál:

Visszaállítja más fémeket az oxidjaikból (iparilag fontos módszer - számítás):
ZSA + CR 2O 3 \u003d ZSAO + 2CR (700-800 ° C)
5A + V 2O 5 \u003d 5SAO + 2V (950 ° C)
Erőteljesen reagál vízzel (magas exo- hatás):
Ca + 2H 2 O \u003d SA (IT) 2 + H 2 ^ + 413 KJ
A stresszsorok sorában jelentősen a hidrogén bal oldalán, hígított sósavval és H2S04 savból, hidrogénből kiszorul (H20 és H + miatt):
Ca + 2H + \u003d Ca 2+ + H 2 ^
Megszerzés Calcium B. ipar:
Kalciumot alkalmazunk, hogy eltávolítsuk a nem-fémes szennyeződéseket a fémötvözetek, mint egy összetevője a tüdő és a súrlódásgátló ötvözetek, hogy kiemelje a ritka fémek a saját oxidok.
Kalcium-oxid Sao. Alap-oxid. Műszaki név oltatlan mész. Fehér, nagyon higroszkópos. A Ca 2+ O 2- ionos szerkezete van. Tűzálló, termikusan stabil, illékonyság, amikor kalcinál. Elnyeli a nedvességet és a szén-dioxidot a levegőből. Erőteljesen reagál vízzel (magas exo- hatás), erős lúgos oldatot (kicsapott hidroxid) képez, a folyamatot hívják Írjon tenyésztést. Reagál savakkal, fémek oxidjai és nemfémek. Ezt alkalmazzák a szintézis más kalcium vegyületek, a termelés Ca (O) 2, CAC 2 ásványi műtrágyák, mint a fluxus a kohászatban, a katalizátor in Organic Synthesis, komponense kötő anyagok az építőiparban.
A legfontosabb reakciók egyenletei:

Megszerzés Sao B. ipar - mészkő tüzelés (900-1200 ° C):
SASO 3 \u003d. Sao + CO 2.
Kálcium hidroxid SA (He) 2. Alapvető hidroxid. Műszaki név oltott mész. Fehér, higroszkópos. A Ca 2+ (IT -) ionszerkezete 2. Mérsékelt fűtéssel bomlik. Elnyeli a nedvességet és a szén-dioxidot a levegőből. Multulatoring a hideg vízben (lúgos oldat képződik), még kevésbé - forró vízben. Átlátszó megoldás ( citromos víz) Gyorsan repül a hidroxid csapadék csökkenése miatt (a szuszpenziót hívják Mész tej). Minőségreakció Az Ion Ca 2+ - szén-dioxid áthaladás a mész vízen keresztül a SASO 3 üledék megjelenésével és az oldathoz való áttéréssel. Reagál savakkal és sav-oxidokkal, csatlakozik az ioncserével.
Az üveg, könnyed mész, lime ásványi műtrágyák előállítására használják, a szóda és a friss víz lágyulását, valamint a mész alapú habarcsok előállítását - kemény keverékek (homok + kimerült mész + víz) kötőanyag kő és téglafal, befejezések (zsalu) falak és egyéb építési célok. Az ilyen oldatok tartott ("beállítása") a levegőből származó széndioxid felszívódásának köszönhető.
A legfontosabb reakciók egyenletei:

Megszerzés SA (ő) 2 in ipar - SAO mész kiszámítása (lásd fent).
5.4. Víz keménysége
Természetes víz, mészkő sziklákon és talajon keresztül, kalciummal és magnéziumsókkal (valamint vasat), és válik merev. A kemény vízben a szappan mosása növekszik, és a szövet, az abszorbeáló só, sárga és gyors szélvé válik. Skála -oldhatatlan kalcium- és magnéziumvegyületek és vas-oxid), az edények, gőzkazánok és csővezetékek belső falán. A kemény vízben a zöldségek, a gabonafélék és a hús hosszabb ideig főtt. Megkülönböztet ideiglenes és állandó víz keménysége.
Az ideiglenes merevséget az M (HCO 3) 2 (M \u003d Ca, Mg) és FE (HCO 3) 2 szénhidrogénezők jelenléte okozza. Ha a HCO 3 ionok tartalma mennyiségi -, azt mondják Karbonát merevség Ha az ionok Ca 2+, MG 2+ és FE 2+ - körülbelül Kalcium, magnézium vagy Vas Merevség. Az ideiglenes merevség magasabb, mint annál nagyobb az ilyen ionok tartalma a vízben. Víz merevség, amelyet ideiglenesnek neveznek, mert az sima forrásban van:
SA (NSO 3) 2 \u003d SASO 3 V + H 2 O + CO 2 ^
Mg (HCO 3) 2 \u003d mg (OH) 2 V + 2СO 2 ^
4FE (HCO 3) 2 + O 2 \u003d 2FE 2O 3 V + 8CO 2 ^ + 4H 2 O
Állandó A merevség a kalcium- és magnézium (szulfátok, kloridok, nitrátok, dihidro-ortofoszfátok stb.) Oka. Az ilyen merevséget nem szabad eltávolítani forró vízzel. Ezért, hogy távolítsa el a merev vizet a legtöbb só, amelyet kémiai reagensek és speciális (ioncsere) módszerek alkalmazásával lágyítanak. A lágyított víz alkalmas ivásra és főzésre.
A víz lágyulása akkor érhető el, ha különböző preipitátorokkal - Hawked mész, nátrium-nátrium és ortofoszfát:
Az időbeli merevség megszüntetése:
SA (NSO 3) 2 + SA (IT) 2 \u003d 2SASO 3 V + 2N 2 O
Mg (HCO 3) 2 + CA (OH) 2 \u003d CAKG (CO 3) 2 V + 2N 2 O
4FE (HCO 3) 2 + 8S (OH) 2 + O 2 \u003d 4FEO (OH) V + 8SASO 3 V + 10N 2 O
Az állandó merevség megszüntetése:
CA (NO 3) 2 + NA 2 CO 3 \u003d CACO 3 V + 2NANO 3
2MGSO 4 + H 2O \u003d Na 2 CO 3 \u003d mg 2 CO 3 (OH) 2 V + CO 2 ^ + 2NA 2NA 2 SO 4
3FECL 2 + 2NA 3 PO 4 \u003d FE 3 (PO 4) 2 V + 6NACL
A vegyipari laboratóriumban és az iparágban teljesen szántott vizet használtunk (ez nem alkalmas ivásra). A sóhajtott víz beszerzése, a természetes víz desztillálva (desztilláció). Ilyen. Desztillált A víz puha, mint az esővíz.
5.5. Alumínium
Alumínium - eleme a 3. harmadban és IIIa-csoport a periódusos rendszer, sorszám 13. Elektronikus képletű egy atom [10 NE] 3S 2 3P 1, oxidációs foka + III és 0.
A villamos energia (1.47) ugyanaz a berillium, az amfoter (sav és alap) tulajdonságokat mutatja. A vegyületekben lehet a kationok és anionok összetételében.
A természetben - negyedik Kémiai prevalenciával az elem (a fémek közül először) kémiailag kapcsolódó állapotban van.
Alumínium Al. Ezüstfehér, fényes, könnyű és műanyag fém. A levegőt matt védőfóliával borítják, AL 2O 3, nagyon stabil és a fém védelme a korrózióból; Vízben passzivált és koncentrált HNO 3 (ugyanolyan oxidfilm képződése).
Reaktív, levegőben éget, szobahőmérsékleten Reagál a Galogének Cl2, BR2 és I 2, fluor, szürke fűtés közben:
4al (por) + 3O 2 (levegő) \u003d 2A 2O 3 (700 ° C)
2al (por) + ze 2 \u003d 2al 3 (25 ° C, e \u003d ci, br)
2al (por) + 3i 2 \u003d 2ali 3 (25 ° C, macska - Drop H20)
2al + 3f 2 \u003d 2alf 3 (600 ° C)
2AL + 3S \u003d AL 2 S 3 (150-200 ° C)
Az alumínium visszaállítja más fémeket az oxidjaikból (iparilag fontos módszer - Alumíniumomia):

Amalgamated alumínium, azaz az oxid filmből, erőteljesen és nagyokkal tisztították exo- hatás reagál a vízzel:
2al + 6n 2 o \u003d 2al (OH) 3 V + Zn 2 ^ + 836 kJ
Alumínium - erős (tipikus) redukálószer, egy sor feszültségben a hidrogén bal oldalán; Hidrogén hidrogénatom hígított savas sósavból és H2 SO 4:
2al + 6n + \u003d 2al 3+ + Zn 2 ^
és amboteritást mutatunk, koncentrált alkáli oldatból (oxidálószer - víz):
2AL + 2NAOH + 6N 2O \u003d 2Na + Zn2 ^ (80 ° C)
Reagál lúgokkal az olvadékban (az amfoter tulajdonságok bemutatása is):
2al + 6naOH (t) \u003d 2naalo 2 + Zn 2 + 2Na 2O (450 ° C)
S. kölcsönhatásba lép hígított salétromsav:
AL + 4NNO 3 (SPZ.) \u003d AL (NO 3) 3 + NO ^ + 2N 2 O
és visszaállítja az n v-t n -iii reakciókat nagyon hígított salétromsav és sói:
8al + z0no 3 (PTS. Razz.) \u003d 8al (3) 3 + 3NH 4 NO 3 + 9H 2O
8al + 18n 2O + 5CONE + 3KNO 3 \u003d 8K + 3NH 3 ^ (Forrás)
(Az Atom-hidrogén H 0 közbenső izolálása ezeknek a reakcióknak a hajtóereje, és a második reakcióban szintén stabil hidroxkomplexképződmény.
Megszerzés Alumínium B. ipar - AL 2O 3 Elektrolízis krioliti olvadékban NA 3 950 ° C-on:
Aluminotherermiában reagensként alkalmazzák, hogy ritka fémeket és acélszerkezetek hőhegesztését kapjunk. Az alumínium a legfontosabb szerkezeti anyag, a könnyű korrózióálló ötvözetek alapja (magnéziummal - dúralumínium vagy dúralumínium, rézzel - Sárga alumínium bronz, Amelyből minimális csere érmék minimalizálnak). Tiszta alumínium nagy mennyiségben az edények és az elektromos vezetékek gyártása.
Alumínium-oxid Al 2 o 3. Az amfoteroxid, savas és alapvető tulajdonságok egyenlőek. Fehér, ionszerkezettel (AL 3+) 2 (O 2-) 3. Tűzálló, termikusan stabil. Az amorf por higroszkópos és kémiailag aktív, kristályos, nagyon szilárd és kémiailag passzív. Nem reagál a savakkal és lúgokkal hígított vízzel. Ez le van fordítva egy oldatot tömény savak és lúgok, reagál lúgokkal és nátrium-karbonát, amikor fixáló. Ezt alkalmazzák nyersanyagként a termelés alumínium, gyártásához tűzálló, kémiailag tartós és csiszoló anyagok, különösen a tiszta Al 2 O 3 - gyártásához rubin lézerek és szintetikus drágakövek (rubin, zafír, stb ), Más fémek oxidjai - CR 2O 3 (piros), TI 2O 3 és FE 2O 3 (kék szín).
A legfontosabb reakciók egyenletei:

(Ezt a reakciót "nyílásra" használják bauxit)
A természetben, része agyag és bauxit Ásványi anyagokat képez korund.
Alumínium-hidroxid Al (oh) 3. Az amfoter hidroxid, savas és alapvető tulajdonságok ugyanolyan expresszálódnak. Fehér, amorf (gél) vagy kristályos. Az AL kommunikáció túlnyomórészt kovalens. Megdöntötte, ha olvadás nélkül felmelegszik. Gyakorlatilag nem oldódik fel vízben. Reagál savakkal, lúgokkal az oldatban és a beégetés során. Nem reagál NH 3H2O, NH 4CL, CO 2, SO 2 és H2 S. Metagidroxid Alo (OH) kémiailag kevésbé aktív, mint Al (OH) 3. Közbenső termék alumínium előállításában. Más alumíniumvegyületek szintetizálása (beleértve cryolitis) Szerves színezékek, mint például a gyomorlé megnövekedett savasságával rendelkező gyógyszer.
A legfontosabb reakciók egyenletei:
Hőhatározatok
alap- és sav disszociáció megoldásban
(A reakciók nagyon kis oldhatóságot jellemeznek vízben, és az oldathoz mellékelt hidroxid amfoteritása ugyanabban az időben, és H + megközelítőleg koncentrációval egyenlő;
Amfoterikai tulajdonságok
Al (oh) 3 + snllsb.) \u003d ALCL 3 + Zn 2 O
AL (O) 3 + NaOH (t) \u003d Naalo 2 + 2 N 2 O (1000 ° C)
Al (OH) 3 + NaOH (Conc.) \u003d Na (P)
-Ért nyugta Az Al (OH) 3 csapadékot általában nem használják, mivel a könnyű tranzit az üledék az oldatba (lásd fent), és hatnak az alumínium-sók ammónia-hidrát. Szobahőmérsékleten, Al (OH) 3 képződik, és ha forró, kevésbé aktív Alo (OH):
Az AL (O) 3 előállítási megfelelő módszer a CO 2 hidroxi komplex oldaton keresztül történő továbbítása:
CO 2 \u003d. Al (OH) 3 V + HCO 3 -
Tetrahidroxalulum (III) Nátrium Na.Komplex só. Olyan kompozíció van szobahőmérsékleten koncentrált NaOH-oldatban. A szilárd állapotban, a készítmény feltételes, hiszen amikor a kristályosodás az oldatból, akkor bonyolult (Na 4, Na 4 et al.). Kiszámításakor, szilárd sók bomlanak diooxalumum (III) nátrium-Naalo 2, A hígítás során a megoldások - Al (OH) 3. Különbözően reagál erős és gyenge savakkal, alumínium-kloriddal és ammónium-karbonáttal.
A legfontosabb reakciók egyenletei:

Megszerzés: Az AL (OH) 3 és az alumínium sók kölcsönhatása NaOH-val koncentrált oldatban:
Al (oh) 3 + NaOH (conc.) \u003d Na.
ALCL 3 + 4NAOH (Conc.) \u003d Na. + 3NACL
Alumínium-oxid (lásd) alkotja, mint közbenső termék, ipari "nyitó" bauxit.
Példák az A. rész feladataira1. A II. Fő alcsoport fémjei között a legerősebb A redukálószer
2) kalcium
3) Stronrysia
2. A levegőben lévő magnézium égetésekor alakul ki
3. Az alumínium kiemeli a reagensből származó hidrogént
1) HNO 3 (RSC)
2) NAHSO 4 (RSC)
3) h 2, 4 (conc.)
4) NaOH (conc.)
4. A helyreállítási reakció az alumínium és az oldatban folytatódik
5. A szénhidrogén-oldatból a bárium leesik a reagensek hozzáadásával
6. A káliumot a szénelektródák elektrolízisével állíthatjuk elő
1) KCL megoldás
2) KNO 3 megoldás
3) olvadék Cl
4) olvadék keverék CCL és MgCl2
7-8. Ha csepp megoldást teszel
7. főzés só
8. Kálium-klorid
a gázégő színtelen lángjában lesz
1) piros
3) zöld
4) Violet
9. A víz időbeli merevségének megszüntetése reakcióval történik.
1) CA (NSO 3) 2 + NA 3 PO 4\u003e ...
2) SA (NSO 3) 2 + SA (He) 2\u003e ...
3) CASO 4 + NA 2 CO 3\u003e ...
Kalcium - Az időszakos rendszer 4. periódusának és IIa-csoportjának eleme, szekvencia 2o. Az atom elektronikus képlete [18 AR] 4S 2, a + II és a 0 oxidációs fokok alkáliföldfémekre vonatkoznak.
Alacsony elektronikus (1,04), manifesztálja a fémes (fő) tulajdonságokat. Számos sót és bináris vegyületet (kationként). Sok kalciumsó kicsi a vízben.
A természetben - hatodik A kémiai prevalenciával egy elem (harmadik a fémek között) a kapcsolódó formában van. Minden szervezet számára létfontosságú elem.
A kalcium hiánya a talajban tele van lime műtrágyák (CACO 3, CAO, CAACN 2 kalcium-cianamid stb.).
A kalcium, a kalcium kation és annak vegyületei színezik a gázégő lángját sötét narancssárga színre ( minőségérzékelés).
Calcium SA. Ezüstös és fehér fém, puha, műanyag. A nedves levegőben a Cao és az SA (OH) 2-ből származó filmben van.
Nagyon reaktív; Gyúlékony levegőben fűtött, hidrogénnel, klórral, szürke és grafitával reagál:
Visszaállítja más fémeket az oxidjaikból (iparilag fontos módszer - számítás):
ZSA + CR 2O 3 \u003d ZSAO + 2CR (700-800 ° C)
5A + V 2O 5 \u003d 5SAO + 2V (950 ° C)
Erőteljesen reagál vízzel (magas exo - hatás):
Ca + 2n 2 O \u003d SA (OH) 2 + H 2 + 413 kJ
A stresszsorok sorában jelentősen a hidrogén bal oldalán, hígított sósavval és H2S04 savból, hidrogénből kiszorul (H20 és H + miatt):
Ca + 2H + \u003d Ca 2+ + H 2
Megszerzés Calcium B. ipar :
Kalciumot alkalmazunk, hogy eltávolítsuk a nem-fémes szennyeződéseket a fémötvözetek, mint egy összetevője a tüdő és a súrlódásgátló ötvözetek, hogy kiemelje a ritka fémek a saját oxidok.
SAO kalcium-oxid. Alap-oxid. Műszaki név oltatlan mész. Fehér, nagyon higroszkópos. A Ca 2+ O 2- ionos szerkezete van. Tűzálló, termikusan stabil, illékonyság, amikor kalcinál. Elnyeli a nedvességet és a szén-dioxidot a levegőből. Erőteljesen reagál vízzel (magas exo - hatás), erős lúgos oldatot (kicsapott hidroxid) képez, a folyamatot hívják Írjon tenyésztést. Reagál savakkal, fémek oxidjai és nemfémek. Ezt alkalmazzák a szintézis más kalcium vegyületek, a termelés Ca (O) 2, CAC 2 ásványi műtrágyák, mint a fluxus a kohászatban, a katalizátor in Organic Synthesis, komponense kötő anyagok az építőiparban.
A legfontosabb reakciók egyenletei:

Megszerzés Sao B. ipar - mészkő tüzelés (900-1200 ° C):
SASO 3 \u003d. Sao + CO 2.
Kalcium-hidroxid (IT) 2. Alapvető hidroxid. Műszaki név oltott mész. Fehér, higroszkópos. A Ca 2+ (IT -) ionszerkezete 2. Mérsékelt fűtéssel bomlik. Elnyeli a nedvességet és a szén-dioxidot a levegőből. Multulatoring a hideg vízben (lúgos oldat képződik), még kevésbé - forró vízben. Átlátszó megoldás ( citromos víz) Gyorsan repül a hidroxid csapadék csökkenése miatt (a szuszpenziót hívják Mész tej). Minőségreakció Az Ion Ca 2+ - szén-dioxid áthaladás a mész vízen keresztül a SASO 3 üledék megjelenésével és az oldathoz való áttéréssel. Reagál savakkal és sav-oxidokkal, csatlakozik az ioncserével.
Az üveg, könnyed mész, lime ásványi műtrágyák előállítására használják, a szóda és a friss víz lágyulását, valamint a mész alapú habarcsok előállítását - kemény keverékek (homok + kimerült mész + víz) kötőanyag kő és téglafal, befejezések (zsalu) falak és egyéb építési célok. Az ilyen oldatok tartott ("beállítása") a levegőből származó széndioxid felszívódásának köszönhető.
A legfontosabb reakciók egyenletei:

Megszerzés SA (ő) 2 in ipar - SAO mész kiszámítása (lásd fent).
5.4. Víz keménysége
Természetes víz, mészkő sziklákon és talajon keresztül, kalciummal és magnéziumsókkal (valamint vasat), és válik merev. A kemény vízben a szappan mosása növekszik, és a szövet, az abszorbeáló só, sárga és gyors szélvé válik. Skála - Oldhatatlan kalcium- és magnéziumvegyületek és vas-oxid), az edények, gőzkazánok és csővezetékek belső falán. A kemény vízben a zöldségek, a gabonafélék és a hús hosszabb ideig főtt. Megkülönböztet ideiglenes és állandó víz keménysége.
Az ideiglenes merevséget az M (HCO 3) 2 (M \u003d Ca, Mg) és FE (HCO 3) 2 szénhidrogénezők jelenléte okozza. Ha a HCO 3 ionok tartalma mennyiségi -, azt mondják Karbonát merevség Ha az ionok Ca 2+, MG 2+ és FE 2+ - körülbelül Kalcium, magnézium vagy Vas Merevség. Az ideiglenes merevség magasabb, mint annál nagyobb az ilyen ionok tartalma a vízben. Víz merevség, amelyet ideiglenesnek neveznek, mert az sima forrásban van:
SA (NSO 3) 2 \u003d SASO 3 ↓ + H20 + CO 2
Mg (HCO 3) 2 \u003d mg (OH) 2 ↓ + 2СO 2
4FE (HCO 3) 2 + O 2 \u003d 2O 2O 3 ↓ + 8CO 2 + 4H 2O
Állandó A merevség a kalcium- és magnézium (szulfátok, kloridok, nitrátok, dihidro-ortofoszfátok stb.) Oka. Az ilyen merevséget nem szabad eltávolítani forró vízzel. Ezért, hogy eltávolítsuk a merev vizet legfőképpen sók, azt lágyított segítségével kémiai reagensek és speciális (ioncsere) módszerek. A lágyított víz alkalmas ivásra és főzésre.
A víz lágyulása akkor érhető el, ha különböző preipitátorokkal - Hawked mész, nátrium-nátrium és ortofoszfát:
az időbeli merevség megszüntetése:
SA (NSO 3) 2 + SA (IT) 2 \u003d 2SASO 3 ↓ + 2n 2 o
Mg (HCO 3) 2 + CA (OH) 2 \u003d camg (CO 3) 2 ↓ + 2n 2 o
4FE (HCO 3) 2 + 8S (OH) 2 + O 2 \u003d 4FEO (OH) ↓ + 8saso 3 ↓ + 10n 2 o
az állandó merevség megszüntetése:
CA (NO 3) 2 + NA 2 CO 3 \u003d CACO 3 ↓ + 2NANO 3
2MGSO 4 + H 2O \u003d Na 2 CO 3 \u003d mg 2 CO 3 (OH) 2 ↓ + CO 2 + 2NA 2 SO 4
3FECL 2 + 2NA 3 PO 4 \u003d FE 3 (PO 4) 2 ↓ + 6NACL
A vegyipari laboratóriumban és az iparágban teljesen szántott vizet használtunk (ez nem alkalmas ivásra). A sóhajtott víz beszerzése, a természetes víz desztillálva (desztilláció). Ilyen. Desztillált A víz puha, mint az esővíz.
Kálium
Nátrium
A fegyelem anyagának és technikai támogatása.
további irodalom
Főirodalom
Tudományágak
Oktatási és módszertani és információs támogatás
Khakhanina T. I. Környezeti kémia [elektronikus erőforrás]: TUTORIAL - M.: YuRait, 2010. - 129 p. // University Library Online: webhely. - Hozzáférési mód: http://www.biblioclub.ru
1. Tarasova, Natalia Pavlovna. Környezetkémia: Atmosphere: Tanulmányok. Tanulmányi kézikönyv Egyetemek / N. P. Tarasova, V. A. Kuznetsov. - M.: Akadémia, 2007. - 227 p. Esipov, Yuri Veniaminovich.
A "Védelmi-objektum-környezet" / Yu rendszerek kockázatának ellenőrzése és értékelése. V. Esipov, F. A. Samsonov, A. I. Cheremisin; Seb, déli. Tudományos Központ. - M.: URSS, 2008. - 136 p.
2. Larionov N. M. Ipari ökológia. [Elektronikus erőforrás]: Tutorial for Bachelors - M.: Yurait, 2012. - 496 p. // University Library Online: webhely. - Hozzáférési mód: http://www.biblioclub.ru
Ahhoz, hogy a munkaprogram teljesítése, a fegyelem „Chemistry bioszféra” az osztály egy anyagi és technikai bázis, amely biztosítja minden típusú képzés, gyakorlati és kutatási munkát a diákok, rá vonatkozó egészségügyi és tűzvédelmi előírások és szabványok. Az interaktív osztályokat a multimédiás berendezésekkel és az internet-hozzáféréssel felszerelt közönségekben tartják.
Nátrium - eleme a 3. harmadban és az IA-csoport a periódusos rendszer, sorszám 11. Az elektronikus képletű atom [10 NE] 3S 1, oxidációs foka + i és 0. Ez a kis electronegitability (0,93), csak a fémes (Fő) tulajdonságok. Számos sót és bináris vegyületet (kationként). Szinte minden nátriumsó a vízben jól oldódik.
A természetben - ötödik Kémiai prevalenciával az elemet (a fémek közül a fémek) csak a kapcsolatok formájában találhatók. Minden szervezet számára létfontosságú elem.
Nátrium, nátrium-kation és vegyületei festék a gázégő lángját fényes sárga színben ( minőségérzékelés).
Nátrium Na. Ezüstfehér fém, fény, puha (késsel vágva), alacsony olvadás. Tárolja a nátriumot kerozinban. A higany formák folyékony ötvözet - Amalgám (legfeljebb 0,2% NA).
Nagyon reakcióképes, a nedves levegő nátrium lassan borított hidroxiddal film és elveszti fényét (dim):
A nátrium kémiailag aktív, erős redukálószer. A levegőben lévő lángok mérsékelt melegítéssel (\u003e 250 ° C), nem fémekkel reagálnak:
2na + o 2 \u003d Na 2O 2 2Na + h 2 \u003d 2nah
2NA + CL 2 \u003d 2NACL 2NA + S \u003d NA 2 S
6na + n 2 \u003d 2NA 3N 2NA + 2C \u003d Na 2 C 2
Nagyon erőszakosan és nagyokkal exo- A nátrium-hatás vízzel reagál:
2NA + 2H 2O \u003d 2NOH + H 2 + 368 kJ
A hőt a reakció, nátrium-darabokat olvadt golyó, amely elkezd mozogni véletlenszerűen felszabadulása miatt a H 2. A reakciót éles kattintások kíséri a csörgőgáz (H2 + O 2) robbanásai miatt. Az oldatot fenolfthalénnel festjük a málna színben (lúgos közeg).
A nátrium-stresszsorban a hidrogén bal oldali, hígított HCI és H2S04 savak, hidrogén elmozdul (H20 és H + miatt).
Megszerzés Nátrium az iparban:
(Lásd még a NaOH átvételét is).
A nátriumot Na 2O 2, NaOH, NaH, valamint szerves szintézis előállítására használják. A megolvasztott nátrium szolgál hűtőközeg atomreaktorok, és gáznemű - alkalmazzák töltőanyagként sárga-szoros lámpák kültéri világítás.
Nátrium-oxid Na 2 O. Alap-oxid. Fehér, ionos szerkezet (Na +) 2 O 2-. Termikusan stabil, kalcinálással lassan bomlik, a Na gőz felesleges nyomása alatt olvad. Érzékeny a nedvességre és a szén-dioxidra a levegőben. Energetikusan reagál vízzel (erősen lúgos oldat képződik), savak, savak és amfoteroxidok, oxigén (nyomás alatt). Nátriumsók szintetizálására szolgál. Nem képződik a nátrium levegőben történő égetésekor.
A legfontosabb reakciók egyenletei:
Szerzés: Hőbomlás Na 2 O 2 (lásd), valamint Na és NaOH, Na és NaOH 2O 2:
2NA + 2NAOH \u003d 2NA O + H2 (600 ° C)
2NA + Na 2O 2 \u003d 2NA AO (130-200 ° C)
Na 2 O 2 nátrium-peroxid. Bináris kapcsolat. Fehér, higroszkópos. Ionos szerkezetű (Na +) 2 O 2 2-. Amikor fűtött bomlik, az O 2 túlnyomás alatt olvad. Felszívja a szén-dioxidot a levegőből. Teljesen bomlik vízzel, savakkal (O 2 szelekció, ha forrásban van - Minőségreakció peroxidokonként). Erős oxidálószer, gyenge redukálószer. Az oxigén regenerálására szolgálsz. A legfontosabb reakciók egyenletei:
2NA 2O 2 \u003d 2Na 2O + O 2 (400-675 ° C, vákuum)
NA 2O 2 + 2N 2 O \u003d H 2O 2 + 2NAOH (hidegen)
2NA 2O 2 + 2N 2 O \u003d O 2 + 4NAOH (forrás)
NA 2O 2 + 2NCL (RSC) \u003d 2NACL + H 2O 2 (hideg)
2NA 2O 2 + 4NCL (RSC) \u003d 4NCI + 2N 2O + O 2 (forrás)
2NA 2O 2 + 2CO 2 \u003d Na 2 CO 3 + O 2
NA 2O 2 + CO \u003d NA 2 CO 3
NA 2O 2 + 4H + + 2I - \u003d I 2 ↓ + 2H 2O + 2NA +
5NA 2O 2 + 16H + + 2MNO 4 - \u003d 5O 2 + 2MN 2+ + 8H 2O + 10NA +
3NA 2O 2 + 2 3- \u003d 2CRO 2 4- + 8OH - + 2H 2O + 6NA + (80 ° C)
Szerzés: Égő na a levegőben.
Nátrium-hidroxid-nátrium-hidroxid. Alapvető hidroxid, alkáli, műszaki név nátrium-hidroxid. Fehér kristályok ionos szerkezetű (Na +) (OH -). A légtelenítő nedvesség és a szén-dioxid vakok (NAHCO 3 képződése). Megolvad és bomlás nélkül elolvad. Súlyos bőrt és szemurítást okoz.
Nos oldható vízben (a exo- hatás, +56 kJ). Reagál sav-oxidokkal, savszegélyszel, savas funkciót okoz az amfoteroxidokban és a hidroxidokban:
NaOH (RSS) + H 3 PO 4 (Conc.) \u003d NAH 2 PO 4 + H 2 O
2naOH (SPL.) + H 3 PO 4 (RSC) \u003d Na 2 HPO 4 + 2H 2O
3naOH (Conc.) + H 3 PO 4 (RSC) \u003d Na 3 PO 4 + 3H 2O
2NAOH (T) + M 2O 3 \u003d 2NAMO 2 + H20 (1000 ° C, M \u003d AL, CR)
2naOH (conc.) + 3H 2O + AI 2O 3 \u003d 2NA (forrás)
2NAOH (T) + M (OH) 2 \u003d Na 2 MO 2 + 2H 2O (500 ° C, M \u003d Be, Zn)
2naOH (conc.) + Zn (OH) 2 \u003d Na 2
Kicsapódik az oldhatatlan hidroxidokat:
2NAOH + MCI 2 \u003d 2NACL + M (OH) 2 ↓ (M \u003d MG, CU)
Diameses halogének és kén:
2naOH (conc., Ház) + E 2 \u003d Nae + Naeo + H 2 O (E \u003d Cl, Br)
6naOH (Split, hegyek) + 3s \u003d 2Na 2 S + Na 2 SO 3 + 3H 2O
Elektrolízisnek van kitéve az olvadékban:
A NaOH-oldat hadtestje az üveg (NASIO 3 képződik), korrodálja az alumínium felületet (Na és H2 képződik).
Megszerzés NaOH B. ipar:
a) elektrolízis NaCl oldat egy inert katódon:
b) NaCl-oldat elektrolízise higany katódon (amalgamy módszer):
(A gyakori higany visszatért az elektrolizátorba).
A kausztikus Natra a vegyipar legfontosabb nyersanyagai. Nátriumsók, cellulóz, szappan, festékek és mesterséges szálak előállítására használják; gázszárítóként; Reagens a másodlagos nyersanyagokból és tisztító ónból és cinkből; Alumínium ércek (bauxit) feldolgozásakor.
Kálium - eleme a 4. időszak és az IA-csoport a periódusos rendszer, sorszám 19. Elektronikus képlet az atom [18 AR] 4S 1, oxidációs foka + i és 0. Ez a kis elektronegativitási (0,91), ez azt mutatja, fémből (Fő) tulajdonságok. Számos sót és bináris vegyületet (kationként). Szinte minden káliumsó a vízben jól oldódik.
A természetben - kilencedik Kémiai prevalenciával az elem (a fémek hatodik) csak a kapcsolatok formájában van. Minden szervezet számára létfontosságú elem.
A talajban lévő kálium hiánya a potash trágyák - CL-klorid, K 2 SO 4 szulfát és növények hamu bevezetésével pótolódik.
Kálium, kálium kálium és csatlakozásai a lila színű gázégő lángját festik ( minőségérzékelés).
Kálium k. Ezüstfehér fém, könnyű, nagyon puha, alacsony olvadás. A káliumot a kerozin réteg alatt tárolja. A higany formák folyékony ötvözet - amalgám.
A kémiai tulajdonságok szerint úgy néz ki, mint a nátrium, de még inkább reaktívabb. A nedves levegő-fúzerekben, amely a hidroxidfóliát lefedi.
A kálium erős rehabilitációs tulajdonságokkal rendelkezik. Aktívan éget a levegőben KO 2-be, reagál a hidrogénnel (KH termék), klór (KCL), szürke (KCL).
Erőteljesen és magas exo- A káliumhatás bomlik a vizet:
2K + 2H 2O \u003d 2KOH + H 2 + 392 KJ,
a kiadott hidrogén azonnal lángolt.
A kálium-stresszsorban sokkal a hidrogén bal oldalán maradt, a hígított sósavakból és a H2S04-ről a hidrogénből (H20 és H +) kiszorulnak, míg a kénsav részlegesen visszaáll az SO 2-re.
Megszerzés kálium B. ipar Egyenlően a nátrium eléréséhez.
Kálium szintetizálására használatos vegyületei (KO 2, KH, sók), mint egy olvadék (a keverékben a Na) -, mint a hűtőközeg a nukleáris reaktorok.
Kálium-hidroxid con. Fő hidroxid, Pitch, Műszaki név Szekrény. Fehér, ionos szerkezete + IT -. Megolvad és bomlás nélkül elolvad. Villog a levegőben, elnyeli a szén-dioxidot (CNSO 3 képződik). Súlyos bőrt és szemurítást okoz.
Nos, vízben oldódik (magas exo- hatás), erősen magas lúgos környezetet teremt megoldásban. Sósavval semlegesítve, savas oxidokkal, amfoter hidroxidokkal és oxidokkal reagál. A koncentrált oldat hadtest az üveg (K 2 SiO 3 képződik).
A Con Industries legfontosabb reakciói és módszerei hasonlóak a tulajdonságokhoz és a NaOH megszerzéséhez.
Szappan előállításánál használják gázok adszorbensként, dehidratálószer, oldhatatlan fémhidroxidok kicsapódása.
Kalcium - Az időszakos rendszer 4. periódusának és IIa-csoportjának eleme, szekvencia 2o. Az atom elektronikus képlete [18 AR] 4S 2, a + II és a 0 oxidációs fokok alkáliföldfémekre vonatkoznak.
Alacsony elektronikus (1,04), manifesztálja a fémes (fő) tulajdonságokat. Számos sót és bináris vegyületet (kationként). Sok kalciumsó kicsi a vízben.
A természetben - hatodik A kémiai prevalenciával egy elem (harmadik a fémek között) a kapcsolódó formában van. Minden szervezet számára létfontosságú elem.
A kalcium hiánya a talajban tele van lime műtrágyák (CACO 3, CAO, CAACN 2 kalcium-cianamid stb.).
A kalcium, a kalcium kation és annak vegyületei színezik a gázégő lángját sötét narancssárga színre ( minőségérzékelés).
Calcium SA. Ezüstös és fehér fém, puha, műanyag. A nedves levegőben a Cao és az SA (OH) 2-ből származó filmben van.
Nagyon reaktív; Gyúlékony levegőben fűtött, hidrogénnel, klórral, szürke és grafitával reagál:
Visszaállítja más fémeket az oxidjaikból (iparilag fontos módszer - számítás):
ZSA + CR 2O 3 \u003d ZSAO + 2CR (700-800 ° C)
5A + V 2O 5 \u003d 5SAO + 2V (950 ° C)
Erőteljesen reagál vízzel (magas exo- hatás):
Ca + 2n 2 O \u003d SA (OH) 2 + H 2 + 413 kJ
A stresszsorok sorában jelentősen a hidrogén bal oldalán, hígított sósavval és H2S04 savból, hidrogénből kiszorul (H20 és H + miatt):
Ca + 2H + \u003d Ca 2+ + H 2
Megszerzés Calcium B. ipar:
Kalciumot alkalmazunk, hogy eltávolítsuk a nem-fémes szennyeződéseket a fémötvözetek, mint egy összetevője a tüdő és a súrlódásgátló ötvözetek, hogy kiemelje a ritka fémek a saját oxidok.
SAO kalcium-oxid. Alap-oxid. Műszaki név oltatlan mész. Fehér, nagyon higroszkópos. A Ca 2+ O 2- ionos szerkezete van. Tűzálló, termikusan stabil, illékonyság, amikor kalcinál. Elnyeli a nedvességet és a szén-dioxidot a levegőből. Erőteljesen reagál vízzel (magas exo- hatás), erős lúgos oldatot (kicsapott hidroxid) képez, a folyamatot hívják Írjon tenyésztést. Reagál savakkal, fémek oxidjai és nemfémek. Ezt alkalmazzák a szintézis más kalcium vegyületek, a termelés Ca (O) 2, CAC 2 ásványi műtrágyák, mint a fluxus a kohászatban, a katalizátor in Organic Synthesis, komponense kötő anyagok az építőiparban.
A legfontosabb reakciók egyenletei:
Megszerzés Sao B. ipar - mészkő tüzelés (900-1200 ° C):
SASO 3 \u003d. Sao + CO 2.
Kalcium-hidroxid (IT) 2. Alapvető hidroxid. Műszaki név oltott mész. Fehér, higroszkópos. A Ca 2+ (IT -) ionszerkezete 2. Mérsékelt fűtéssel bomlik. Elnyeli a nedvességet és a szén-dioxidot a levegőből. Multulatoring a hideg vízben (lúgos oldat képződik), még kevésbé - forró vízben. Átlátszó megoldás ( citromos víz) Gyorsan repül a hidroxid csapadék csökkenése miatt (a szuszpenziót hívják Mész tej). Minőségreakció Az Ion Ca 2+ - szén-dioxid áthaladás a mész vízen keresztül a SASO 3 üledék megjelenésével és az oldathoz való áttéréssel. Reagál savakkal és sav-oxidokkal, csatlakozik az ioncserével.
Az üveg, könnyed mész, lime ásványi műtrágyák előállítására használják, a szóda és a friss víz lágyulását, valamint a mész alapú habarcsok előállítását - kemény keverékek (homok + kimerült mész + víz) kötőanyag kő és téglafal, befejezések (zsalu) falak és egyéb építési célok. Az ilyen oldatok tartott ("beállítása") a levegőből származó széndioxid felszívódásának köszönhető.
A legfontosabb reakciók egyenletei:
Megszerzés SA (ő) 2 in ipar - SAO mész kiszámítása (lásd fent).
5.4. Víz keménysége
Természetes víz, mészkő sziklákon és talajon keresztül, kalciummal és magnéziumsókkal (valamint vasat), és válik merev. A kemény vízben a szappan mosása növekszik, és a szövet, az abszorbeáló só, sárga és gyors szélvé válik. Skála -oldhatatlan kalcium- és magnéziumvegyületek és vas-oxid), az edények, gőzkazánok és csővezetékek belső falán. A kemény vízben a zöldségek, a gabonafélék és a hús hosszabb ideig főtt. Megkülönböztet ideiglenes és állandó víz keménysége.
Az ideiglenes merevséget az M (HCO 3) 2 (M \u003d Ca, Mg) és FE (HCO 3) 2 szénhidrogénezők jelenléte okozza. Ha a HCO 3 ionok tartalma mennyiségi -, azt mondják Karbonát merevség Ha az ionok Ca 2+, MG 2+ és FE 2+ - körülbelül Kalcium, magnézium vagy Vas Merevség. Az ideiglenes merevség magasabb, mint annál nagyobb az ilyen ionok tartalma a vízben. Víz merevség, amelyet ideiglenesnek neveznek, mert az sima forrásban van:
SA (NSO 3) 2 \u003d SASO 3 ↓ + H20 + CO 2
Mg (HCO 3) 2 \u003d mg (OH) 2 ↓ + 2СO 2
4FE (HCO 3) 2 + O 2 \u003d 2O 2O 3 ↓ + 8CO 2 + 4H 2O
Állandó A merevség a kalcium- és magnézium (szulfátok, kloridok, nitrátok, dihidro-ortofoszfátok stb.) Oka. Az ilyen merevséget nem szabad eltávolítani forró vízzel. Ezért, hogy eltávolítsuk a merev vizet legfőképpen sók, azt lágyított segítségével kémiai reagensek és speciális (ioncsere) módszerek. A lágyított víz alkalmas ivásra és főzésre.
A víz lágyulása akkor érhető el, ha különböző preipitátorokkal - Hawked mész, nátrium-nátrium és ortofoszfát:
az időbeli merevség megszüntetése:
SA (NSO 3) 2 + SA (IT) 2 \u003d 2SASO 3 ↓ + 2n 2 o
Mg (HCO 3) 2 + CA (OH) 2 \u003d camg (CO 3) 2 ↓ + 2n 2 o
4FE (HCO 3) 2 + 8S (OH) 2 + O 2 \u003d 4FEO (OH) ↓ + 8saso 3 ↓ + 10n 2 o
az állandó merevség megszüntetése:
CA (NO 3) 2 + NA 2 CO 3 \u003d CACO 3 ↓ + 2NANO 3
2MGSO 4 + H 2O \u003d Na 2 CO 3 \u003d mg 2 CO 3 (OH) 2 ↓ + CO 2 + 2NA 2 SO 4
3FECL 2 + 2NA 3 PO 4 \u003d FE 3 (PO 4) 2 ↓ + 6NACL
A vegyipari laboratóriumban és az iparágban teljesen szántott vizet használtunk (ez nem alkalmas ivásra). A sóhajtott víz beszerzése, a természetes víz desztillálva (desztilláció). Ilyen. Desztillált A víz puha, mint az esővíz.
Kalcium - Az időszakos rendszer 4. periódusának és IIa-csoportjának eleme, szekvencia 2o. Az atom elektronikus képlete [18 AR] 4S 2, a + II és a 0 oxidációs fokok alkáliföldfémekre vonatkoznak.
Alacsony elektronikus (1,04), manifesztálja a fémes (fő) tulajdonságokat. Számos sót és bináris vegyületet (kationként). Sok kalciumsó kicsi a vízben.
A természetben - hatodik A kémiai prevalenciával egy elem (harmadik a fémek között) a kapcsolódó formában van. Minden szervezet számára létfontosságú elem.
A kalcium hiánya a talajban tele van lime műtrágyák (CACO 3, CAO, CAACN 2 kalcium-cianamid stb.).
A kalcium, a kalcium kation és annak vegyületei színezik a gázégő lángját sötét narancssárga színre ( minőségérzékelés).
Calcium SA. Ezüstös és fehér fém, puha, műanyag. A nedves levegőben a Cao és az SA (OH) 2-ből származó filmben van.
Nagyon reaktív; Gyúlékony levegőben fűtött, hidrogénnel, klórral, szürke és grafitával reagál:
Visszaállítja más fémeket az oxidjaikból (iparilag fontos módszer - számítás):
ZSA + CR 2O 3 \u003d ZSAO + 2CR (700-800 ° C)
5A + V 2O 5 \u003d 5SAO + 2V (950 ° C)
Erőteljesen reagál vízzel (magas exo - hatás):
Ca + 2n 2 O \u003d SA (OH) 2 + H 2 + 413 kJ
A stresszsorok sorában jelentősen a hidrogén bal oldalán, hígított sósavval és H2S04 savból, hidrogénből kiszorul (H20 és H + miatt):
Ca + 2H + \u003d Ca 2+ + H 2
Megszerzés Calcium B. ipar :
Kalciumot alkalmazunk, hogy eltávolítsuk a nem-fémes szennyeződéseket a fémötvözetek, mint egy összetevője a tüdő és a súrlódásgátló ötvözetek, hogy kiemelje a ritka fémek a saját oxidok.
SAO kalcium-oxid. Alap-oxid. Műszaki név oltatlan mész. Fehér, nagyon higroszkópos. A Ca 2+ O 2- ionos szerkezete van. Tűzálló, termikusan stabil, illékonyság, amikor kalcinál. Elnyeli a nedvességet és a szén-dioxidot a levegőből. Erőteljesen reagál vízzel (magas exo - hatás), erős lúgos oldatot (kicsapott hidroxid) képez, a folyamatot hívják Írjon tenyésztést. Reagál savakkal, fémek oxidjai és nemfémek. Ezt alkalmazzák a szintézis más kalcium vegyületek, a termelés Ca (O) 2, CAC 2 ásványi műtrágyák, mint a fluxus a kohászatban, a katalizátor in Organic Synthesis, komponense kötő anyagok az építőiparban.
A legfontosabb reakciók egyenletei:
Megszerzés Sao B. ipar - mészkő tüzelés (900-1200 ° C):
SASO 3 \u003d. Sao + CO 2.
Kalcium-hidroxid (IT) 2. Alapvető hidroxid. Műszaki név oltott mész. Fehér, higroszkópos. A Ca 2+ (IT -) ionszerkezete 2. Mérsékelt fűtéssel bomlik. Elnyeli a nedvességet és a szén-dioxidot a levegőből. Multulatoring a hideg vízben (lúgos oldat képződik), még kevésbé - forró vízben. Átlátszó megoldás ( citromos víz) Gyorsan repül a hidroxid csapadék csökkenése miatt (a szuszpenziót hívják Mész tej). Minőségreakció Az Ion Ca 2+ - szén-dioxid áthaladás a mész vízen keresztül a SASO 3 üledék megjelenésével és az oldathoz való áttéréssel. Reagál savakkal és sav-oxidokkal, csatlakozik az ioncserével.
Az üveg, könnyed mész, lime ásványi műtrágyák előállítására használják, a szóda és a friss víz lágyulását, valamint a mész alapú habarcsok előállítását - kemény keverékek (homok + kimerült mész + víz) kötőanyag kő és téglafal, befejezések (zsalu) falak és egyéb építési célok. Az ilyen oldatok tartott ("beállítása") a levegőből származó széndioxid felszívódásának köszönhető.
A legfontosabb reakciók egyenletei:
Megszerzés SA (ő) 2 in ipar - SAO mész kiszámítása (lásd fent).
5.4. Víz keménysége
Természetes víz, mészkő sziklákon és talajon keresztül, kalciummal és magnéziumsókkal (valamint vasat), és válik merev. A kemény vízben a szappan mosása növekszik, és a szövet, az abszorbeáló só, sárga és gyors szélvé válik. Skála - Oldhatatlan kalcium- és magnéziumvegyületek és vas-oxid), az edények, gőzkazánok és csővezetékek belső falán. A kemény vízben a zöldségek, a gabonafélék és a hús hosszabb ideig főtt. Megkülönböztet ideiglenes és állandó víz keménysége.
Az ideiglenes merevséget az M (HCO 3) 2 (M \u003d Ca, Mg) és FE (HCO 3) 2 szénhidrogénezők jelenléte okozza. Ha a HCO 3 ionok tartalma mennyiségi -, azt mondják Karbonát merevség Ha az ionok Ca 2+, MG 2+ és FE 2+ - körülbelül Kalcium, magnézium vagy Vas Merevség. Az ideiglenes merevség magasabb, mint annál nagyobb az ilyen ionok tartalma a vízben. Víz merevség, amelyet ideiglenesnek neveznek, mert az sima forrásban van:
SA (NSO 3) 2 \u003d SASO 3 ↓ + H20 + CO 2
Mg (HCO 3) 2 \u003d mg (OH) 2 ↓ + 2СO 2
4FE (HCO 3) 2 + O 2 \u003d 2O 2O 3 ↓ + 8CO 2 + 4H 2O
Állandó A merevség a kalcium- és magnézium (szulfátok, kloridok, nitrátok, dihidro-ortofoszfátok stb.) Oka. Az ilyen merevséget nem szabad eltávolítani forró vízzel. Ezért, hogy eltávolítsuk a merev vizet legfőképpen sók, azt lágyított segítségével kémiai reagensek és speciális (ioncsere) módszerek. A lágyított víz alkalmas ivásra és főzésre.
A víz lágyulása akkor érhető el, ha különböző preipitátorokkal - Hawked mész, nátrium-nátrium és ortofoszfát:
az időbeli merevség megszüntetése:
SA (NSO 3) 2 + SA (IT) 2 \u003d 2SASO 3 ↓ + 2n 2 o
Mg (HCO 3) 2 + CA (OH) 2 \u003d camg (CO 3) 2 ↓ + 2n 2 o
4FE (HCO 3) 2 + 8S (OH) 2 + O 2 \u003d 4FEO (OH) ↓ + 8saso 3 ↓ + 10n 2 o
az állandó merevség megszüntetése:
CA (NO 3) 2 + NA 2 CO 3 \u003d CACO 3 ↓ + 2NANO 3
2MGSO 4 + H 2O \u003d Na 2 CO 3 \u003d mg 2 CO 3 (OH) 2 ↓ + CO 2 + 2NA 2 SO 4
3FECL 2 + 2NA 3 PO 4 \u003d FE 3 (PO 4) 2 ↓ + 6NACL
A vegyipari laboratóriumban és az iparágban teljesen szántott vizet használtunk (ez nem alkalmas ivásra). A sóhajtott víz beszerzése, a természetes víz desztillálva (desztilláció). Ilyen. Desztillált A víz puha, mint az esővíz.
Mit fogunk tenni a kapott anyaggal:
Ha ez az anyag hasznos lehet az Ön számára, akkor mentheti el a közösségi hálózati oldalra:
| Csipog |
E szakasz összes témája:
Közös elemek. Az atomok szerkezete. Elektronikus kagyló. Orbitális
A kémiai elem egy bizonyos típusú atom, amelyet a cím és a szimbólum jelez, és a szekvencia szám és a relatív atomtömeg jellemzi. A lapon. 1 perera
Mindegyik orbitálisban nem lehet több, mint két elektron
Egy elektront az orbitálokban párosítják, két elektron - elektron pár:
Az elemek tulajdonságai időszakos függőség a szekvencia számától függően
Az elemek elektronikus héjának összetételének módosításának időszakosan megismételt természete megmagyarázza az elemek tulajdonságainak időszakos változását
Molekulák. Kémiai kötés. Az anyagok szerkezete
A két vagy több atomból kialakított vegyi részecskéket molekuláknak nevezzük (valós vagy feltételes formális poliatomiális anyagok). Atomok a molban
Alumínium
Alumínium - az időszakos rendszer 3. periódusának és IIIA-csoportjának eleme, a 13-as szekvenciaszám, a 3S23P1 atom elektronikus képlete,
Mangán
A mangán - az időszakos rendszer 4. periódusának és Viib-csoportjának eleme, a 25. sorszám száma. A 3D54S2 atom elektronikus képlete;
A fémek általános tulajdonságai. Korrózió
Az elemek fém tulajdonságokkal rendelkeznek az időszakos rendszer (7. táblázat).
Hidrogén
A hidrogén az időszakos rendszer első eleme (1. periódus, 1. sorszám). Nem rendelkezik teljes analógiával a vegyi elemek többi részével, és nem tartozik semmilyen
Klór. Klororod
A 3. periódus és a VII A-csoport a periodikus rendszer, a 17. szekvencia-szám, a 3S23P5 atom, ha
Klorida
NaCl nátrium-klorid. Nehéz só. Háztartási név só só. Fehér, gyengítő. Megolvad és bomlás nélkül elolvad. Mérsékelten oldószer
Hipokloriták. Klorát
Kalcium hipoklorita CA (CLO) 2. HCLO klorid-só. Fehér, amikor felmelegedtek az olvadás nélkül. Jól oldódik a hideg vízben (ARR
Bromidok. Iodidi.
Bromid kálium cbr. Nehéz só. Fehér, nem higroszkópos, olvadásmentes bomlás nélkül. Nos oldható vízben, nincs hidrolízis. Restorener (gyengébb, h
Oxigén
Oxigén - eleme a 2. időszak és a VIA csoportjába a periódusos rendszer, sorszám 8, utal chalcoops (de gyakrabban tekintik külön-külön). Elektronikus fd
Kén. Hidrogén-szulfid. Szulfida
A 3. periódus és a periodikus rendszer, a 16-as szekvencia-csoport, a 16-as szekvencia-szám, amely a Chalcogensre vonatkozik. A 3S atom elektronikus képlete
A kén-dioxid. Szulfitok
Sulfur-dioxid SO2. Sav-oxid. Színtelen gáz éles illatú. A molekula egy befejezetlen háromszög szerkezete [: S (O) 2] (SP
Kénsav. Szulfátok
Kénsav H2S04. Oxocsav. Színtelen folyadék, nagyon viszkózus (olajos), nagyon higroszkópos. Molek
Nitrogén. Ammónia
Nitrogén - Az időszakos rendszer második periódusának és VA-csoportjának eleme, 7. szekvencia / 2S22P3 atom, karakter
Nitrogén-oxidok. Salétromsav
Nitrogén-monooxid NO. Nem működő oxid. Színtelen gáz. A radikális tartalmaz egy kovalens σπ-kötést (N \u003d O), szilárd állapotú dimer n2
Nitrit. Nitrát
Nitrit káliumkno2. Oxoszol. Fehér, higroszkópos. Megolvasztja bomlás nélkül. Rezisztens száraz levegőben. Nagyon jól oldódik a vízben (a besmev alakul ki
Szén szabad formában
A periodikus rendszer második periódusának és IVA-csoportjának széneleme, 6. szekvenciaszám. Szénkémiai anyagok főként a szerves vegyületek kémiája; szervetlen
Szén-oxidok
Szénmonoxid CO. Nem működő oxid. Színtelen gáz, szagtalan, könnyebb, mint a levegő. A molekula gyengeolarin, tartalmaz egy kovalens hármas σππ
Karbonátok
Na2C03 nátrium-karbonát. Oxoszol. Műszaki név kalcinált szóda. Fehér, fűtés olvad és bomlik. Érzékeny
Szilícium
Szilikon - az időszakos rendszer 3. periódusának és IVA-csoportjának eleme, a 14-es szekvencia száma. A 3S23P2 atom elektronikus képlete. H.
Alkána. Cikloalkánok
Az alkánok (paraffinok) szénvegyületek hidrogénnel rendelkeznek, amelyek molekuláiban a szénatomok összekapcsolódnak egyetlen kötéssel (korlátozó szénhidrogén
Alkenes. Alkádien
Alkének (olefinek) szénhidrogének, amelyben a szénatomokat tartalmazzák a szénmolekulákban, kettős kötéssel (telítetlen szénhidrogén-sorozat
Alkoholok. Egyszerű éterek. Fenolok
Alkoholok - funkcionális csoportot tartalmazó szénhidrogén-származékok (hidroxil). Alkoholok, amelyekben van egy csoport, amit egyirányúnak neveznek
Aldehidek és ketonok
Az aldehidek és ketonok olyan szénhidrogének származékai, amelyek funkcionális karbonilcsoportot tartalmaznak. Aldehidában a karbonilcsoport kapcsolódik
Karbonsavak. Észterek. Zsír.
A karbonsavak olyan szénhidrogének származékai, amelyek funkcionális csoportot tartalmaznak Coxy (karboxil). Formulák és néhány közös ka nevei
Szénhidrátok
A szénhidrátok (cukor) lényeges természetes vegyületek, amelyek szénből, hidrogénből és oxigénből állnak. A szénhidrátokat monoszacharidokra, diszacharidokra és polisra osztják
Nitro vegyület. Aminok
Nagyon fontos a nemzetgazdaságban nitrogéntartalmú szerves anyagok. A nitrogén a szerves vegyületeket a NO2 nitrocsoportok formájában, az NH2 aminocsoport és a
Aminosavak. Fehérjék
Aminosavak - két funkcionális csoportot tartalmazó szerves vegyületek összetételében - savas coxy és amin NH2
Reakciósebesség
A kémiai reakció áramlási sebességének mennyiségi jellemzője A + B → D + E a sebesség, azaz a reagensek részecskéinek kölcsönhatásának sebessége a
A kémiai reakció sebessége közvetlenül arányos a moláris reagensek koncentrációjának termékével.
Ha a reakció két reagáló molekula ütközését igényli. Ezt a függést a meglévő tömegek kinetikus törvényének nevének nevezik (K. Gulberg, P. VOG
Energia-reakciók
Bármely reakciót a hő formájában történő kiválasztás vagy áramfelszívódás kíséri. A kiindulási anyagokban a kémiai kötések megszakadnak, és ezt az energiára fordítják (azaz azt
Reverzibilis reakciók
A kémiai reakciót reverzibilisnek nevezzük, ha nemcsak a közvetlen reakció (→) ezek a körülmények között áramlik, hanem a fordított reakció, amely a forrás anyagokból származik
Egy egyensúlyi rendszernek van kitéve, kémiai egyensúlyi eltolódik e hatás felé
Tekintsük részletesebben az ilyen tényezők hőmérsékletét, nyomást, koncentrációját, az egyensúly egyensúlyát. 1. Hőmérséklet. Fokozott hőmérséklet
Az anyagok vízben való oldhatósága
A megoldás két vagy több anyagból álló homogén rendszer, amelynek tartalma bizonyos határértékeken belül megváltoztatható a homogenitás megsértése nélkül.
Elektrolitikus disszociáció
A vízben lévő anyagok feloldódását a hidrátok képződése kíséri. Ha ebben az oldatban nincsenek képletek az oldott anyag részecskéiben, akkor egy ilyen anyag
A víz disszociációja. Szerda megoldások
A víz maga egy nagyon gyenge elektrolit:
Ioncsere reakciók
Az elektrolitok hígított oldataiban (savak, bázisok, sók), kémiai reakciók általában az ionok részvételével fordulnak elő. Ebben az esetben a reagensek összes elemét meg lehet tartani.
Sók hidrolízisa
A sóhidrolízis a vízionok kölcsönhatása, amely savas vagy lúgos közeg megjelenését eredményezi, de nem az üledék vagy a gáz kialakulása (az alábbiakban)
Oxidifikerek és redukálószerek
A Redox Reakciók egyidejű növekedéssel és az elemek oxidációjával történő csökkenésével és az elektronátvitelhez mellékelni kell:
Az együtthatók kiválasztása elektronikus egyenleggel
A módszer több szakaszból áll. 1. rögzítse a reakciót; Olyan elemeket találnak, amelyek növelik és csökkentik oxidációs fokokat, és kivonják
Számos feszültségű fém
A fémek sorában a nyíl megfelel a fémek csökkentési kapacitásának csökkenéséhez, valamint a kationuk oxidatív képességének növekedése vizes oldatban (savas környezetben):
Elektrolízis olvadék és oldat
Az elektrolízis egy redox feldolgozási folyamat, amely az elektródákon fordul elő, amikor a közvetlen elektromos áram áthalad a megoldásokon vagy
Az oldott anyagok tömegrésze. Az oldatok hígítása, koncentrációja és keverése
Az (ω c) oldott anyag tömegrésze az anyag tömegének aránya az oldat tömegében (m (p)
A gázok volumetrikus aránya
Az A + B B \u003d C C + D D kémiai reakcióhoz az arányt elvégezzük
Tömeg (térfogat, anyagmennyiség) termék a reagensnél a feleslegben vagy szennyeződésekben
Felesleg és a reagensek hiánya. A reagensek mennyiségét, tömegeit és mennyiségét (gázok) nem mindig sztöchiometrikus, azaz a reakcióegyenletekkel összhangban. C.
A szerves vegyület molekuláris formulájának megtalálása
Az anyagok formuláinak eltávolításakor, különösen a szerves kémiában, a relatív gáz sűrűségét gyakran használják. A gáz relatív sűrűsége x az abszolút aránya
A csontváz bonyolultabbá teszi, de a test nem képes önálló elemet készíteni. Beszéd a kalciumról. A felnőtt nők és férfiak naponta legalább 800 mg-os alkáliföldfémet kell kapniuk. Lehetőség van eltávolítani a zabpehely, mogyoró, tej, árpa gabonafélék, tejföl, bab, mandula.
Kalciuma borsóban, mustárban, túróban. Igaz, ha édességekkel, kávéval, kólával és termékekkel kombinálja őket, gazdag oxálsavat, az elem emészthetősége.
A gyomor közeg lúgossá válik, a kalciumot oldhatatlan és a szervezetből származtatjuk. A csontok és a fogak összeomlanak. Mi ez az elemen, mivel az élő lények egyik legfontosabb dologává vált, és van-e olyan anyag, amely organizmusukon kívül van?
A kalcium kémiai és fizikai tulajdonságai
Az időszakos rendszerben az elem a 20. helyet foglalja el. A 2. csoport fő alcsoportjában található. Az a határidő, amelyre a kalcium tartozik, 4. Ez azt jelenti, hogy egy anyagi atomnak 4 elektronikus szintje van. 20 elektronikus elektronok, amelyek az elem atomszámát jelzik. Ő is tanúsítja a díjat - +20.
Kalcium a testben, mint a természet, egy alkáliföldfém. Tehát tiszta formában az elem ezüstfehér, fényes és fény. Az alkáliföldfémek keménysége magasabb, mint a lúgos.
Calcium index - körülbelül 3 pont. Ugyanez a keménység gipsz. A 20. elemet késsel vágják, de sokkal nehezebb, mint bármelyik alkálifém.
Mi a "alkáliföld" név lényege? Tehát kalcium és más csoportjai csoportja dubédolt alkimisták. Az elemek oxidjai, amelyeket a földek neveznek. Az anyagok oxidjai kalciumcsoportok Alkalmazzon lúgos környezetet.
Azonban radium, bárium, valamint a 20. elem nemcsak oxigénnel kombinálva van. Természetben sok só kalcium. A leghíresebb közülük a kalcit ásványi anyag. Szén-dioxid fém - nem érzékeny kréta, mészkő és vakolat. Mindegyikük van kálcium-karbonát.
Vannak 20 elem és illékony kapcsolat. A lángot narancssárga-vörösre festik, ami az anyagok egyike lesz az anyagok meghatározásához.
Minden alkáliföldfém könnyen ég. Annak érdekében, hogy a kalcium az oxigénnel való reakcióba lépett, kellően hagyományos körülmények között. Csak itt van a természetben Az elem nem fordul elő tiszta formában, csak a kapcsolatokban.

Oxy kalcium- A film, amely fémből van borítva, levegőben van. Flip sárgás. Ez rejtett nem csak standard oxidok, hanem peroxid, nitridek is. A kalciumon kívül nincs levegőben, de vízben, kiemeli a hidrogént.
Ugyanakkor a csapadék esik kálcium hidroxid. A tiszta fémmaradványok lebegnek a felületre, hidrogénbuborékokkal. Ugyanaz a rendszer savakkal működik. Sóval, például az üledék esik kalcium-kloridÉs a hidrogén megkülönböztethető.
Néhány reakció esetében magas hőmérsékletre van szükség. Ha 842 fok, kalcium lehetolvad. Az 1,484-es skálán Celsius, a fém forr.
Kalcium-megoldás, Mint egy tiszta elem, jól végezzen meleg és elektromos áramot. De ha az anyag erősen felmelegszik, a fém tulajdonságok elvesznek. Vagyis nem az olvadt, sem a gáz halmazállapotú kalciumban.
Az emberi testben az elemet szilárd és folyékony összesített állapotok képviselik. Lágyított kalciumvízamely jelen van, könnyebben átadódik. A csontokon kívül a 20. anyag mindössze 1% -a van.
Azonban a szövetek szállítása fontos szerepet játszik. A kalcium-vér beállítja az izmok összehúzódását, beleértve a szívét, a vérnyomást normális módon fenntartja.
Kalciumhasználat
A tiszta formában a fémet használják. Az akkumulátor rácsokba mennek. A kalciumötvözet jelenléte 10-13% Csökkenti az akkumulátor önkicióját. Ez különösen fontos a helyhez kötött modellekhez. Az ólom keverékéből és a 20. elemből készülnek, szintén csapágyak. Az egyik ötvözetnek nevezhető.

A kalciumot tartalmazó fotótermékekben
Az acél lúgos földfém hozzáadódik a kén szennyeződésekből származó ötvözet tisztításához. A kalcium reduktikus tulajdonságait is lenyűgözik az urán, a króm, a cézium, a rubídium termelésében ,.
Milyen kalciumalkalmazzon vas kohászatban? Ugyanaz a tiszta. Az elem hozzárendelésének különbsége. Most szerepet játszik. Ez egy additív az ötvözetekhez, amely csökkenti a képződésük hőmérsékletét és megkönnyíti a salak elválasztását. Kalcium-granulátumok Elalszik az elektrovacuum eszközökben, hogy eltávolítsa a számokat.
A 48. izotóp-kalcium az atomi vállalkozásoknál keres. Vannak szuperheavy elemek. A nyersanyagokat magorszívóknál kapjuk meg. Az ionok - sajátos kagyló segítségével gyorsítják őket. Ha CA48 szerepe van a szerepükben, a szintézis hatékonysága több százszor növeli az ionok használata más anyagok használatát.
Az optikában a 20. elemet már vegyületekként értékelik. A kalcium-fluorid és a volfrám lencsék, lencsék és csillagászati \u200b\u200bműszer prizmákká válnak. Ásványi anyagok és lézeres technológia található.

A kalcium-fluorid geológiákat fluoritnak és Wolframid-Scheelitenek nevezik. Az optikai ipar, ezek egyes kristályok vannak kiválasztva, hogy van, az egyes, a nagy egységek folyamatos rács és tiszta formában.
Az orvostudományban a nem tiszta fém, de az azt alapuló anyagot írják elő. Könnyebb a szervezet asszimilálása. Kalcium-glükonát- A legolcsóbb eszközt az osteoporosis alkalmazásban használják. Drog " Kalcium-magnézium»A serdülőknek, a terhes nőknek és az idősebb állampolgároknak kell előírnunk.
Szükség van arra, hogy a 20. elemben fokozott testre szabhassanak, elkerüljék a fejlesztési patológiákat. Kalcium és foszforsavváltás "Calcium D3". A címben a "D3" a D-vitamin jelenlétéről beszél. Ritka, de teljes asszimilációra van szükség kalcium.
Utasításnak nek "Calcium Nomed3"azt jelzi, hogy a gyógyszer a kombinált hatás gyógyszerkészítményeire vonatkozik. Ugyanezről van szó kalcium-klorid. Ez nem csak a 20. elem hiányát tölti ki, hanem a mérgezésből, valamint a vérplazmának cseréjét is. Néhány kóros állapotban van szükség.
A gyógyszertárakban a gyógyszer is ki van állítva Kalciumsavaszkorbiás. " Az ilyen duót a terhesség alatt, a szoptatás során írják elő. Adalékanyagokra és tinédzserekre van szükségünk.
Kalciumbányászat
Kalcium a termékekben, ásványi anyagok, kapcsolatok, az emberiség által okozott őszinte. A legtisztább formában a fémet csak 1808. évben osztották fel. Sok szerencsét mosolygott Chemphri Davy-t. Az angol fizikus az elolvadt sói elektrolízissel termelt kalciumot. Ezt a módszert most használják.

Az iparosok azonban gyakrabban érkeznek a második módszerre, a Chemphrey után nyitva. A kalcium az oxidjától visszaáll. A reakciót por, néha por hajtja végre. Az interakció vákuum körülmények között emelkedett hőmérsékleten halad át. Első alkalommal a kalciumot a múlt század közepén, az Egyesült Államokban osztották fel.
Kalciumár
A fém kalciumgyártók egy kicsit. Tehát Oroszországban a szállítások elkötelezettek, főleg egy kempetek mechanikai üzem. Udmurtiában van. A vállalat granulátumokkal, zsetonokkal és fémszeletekkel foglalkozik. Az árcédulát egy csomó nyersanyaghoz tartják az 1500 dolláros területen.
Az árukat is kínálnak egyes kémiai laboratóriumok, például a társadalom „orosz vegyész”. Utolsó, 100 grammot kínál kalcium. Véleményjelzi, hogy ez az olaj alatt van. Az egyik csomag költsége 320 rubel.
A reál kalcium megvásárlására, az internetes kereskedelemre és az üzleti tervekre vonatkozó javaslatokon kívül. Körülbelül 7 oldal elméleti számítások kb. 200 rubel. A legtöbb terv 2015-ben készült, vagyis még nem veszítette el a relevanciát.