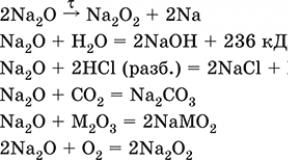A D-elemek általános jellemzői. Az ón atom szerkezete 4 m-es időszak
Időszakos törvény.
Épület atom
A cikk bemutatja a tesztfeladatok tesztelését a szerzők által a 8. osztályú tematikus ellenőrzésre készített vizsgálati feladatok témájában. (Bankkapacitás - 80 feladat a hat téma mindegyikének a 8. osztályban, és a "Szervetlen vegyületek alaposztályának" témájú 120 feladata.) Jelenleg a 8. osztályban a kémiai képzést kilenc tankönyvben végzik. Ezért a cikk végén a tudás ellenőrzött elemeinek listáját jelzi a feladatszámokat. Ez lehetővé teszi a különböző programokban dolgozó tanárok számára, hogy kiválasszák az egyik témáról, mind a különböző témákból származó vizsgálati feladatok kombinációját, beleértve a végső vezérlést is.
A javasolt 80 vizsgálati feladatokat négy lehetőségben 20 kérdéssel csoportosítják, amelyekben hasonló feladatok megismétlődnek. A fordításhoz több opciót a listából tudáselemek válassza (véletlenszerűen) feladat számok minden vizsgált tétel összhangban a tematikus tervezés. Az egyes témákhoz hasonló feladatok ilyen bemutatása lehetővé teszi, hogy a hibák gyors elemzését és időben korrekcióját töltsük. Hasonló feladatok használata az egyik kiviteli alakban, az egyik vagy két helyes válasz váltása csökkenti a válasz megtalálásának valószínűségét. A kérdések összetettsége, általában az 1. és 2. lehetőségektől a 3. és 4. lehetőségekig növekszik.
Úgy véli, hogy a tesztek "találgatás". Javasoljuk, hogy ellenőrizze, hogy van-e. A tesztelés után hasonlítsa össze az eredményeket a jelekkel. Ha a vizsgálati eredmények alatt vannak, a következő okokból magyarázható.
Először is, az ilyen (teszt) szokatlan a diákok számára. Másodszor, a tanár hangsúlyt fektet a téma tanulmányozására (meghatározó az oktatási és oktatási módszertan tartalmának fő tartalmának meghatározása).
1.opció
Feladatok.
1. A 4. periódusban a VIA Csoport egy sorszámú elem:
1) 25; 2) 22; 3) 24; 4) 34.
2. Az Atom +12 nukleuszának töltésével ellátott elem szekvenciaszámmal rendelkezik:
1) 3; 2) 12; 3) 2; 4) 24.
3. Az elem sorszáma megfelel ennek a jellemzőknek:
1) az atommagok töltése;
2) a protonok száma;
3) a neutronok száma;
4. Hat elektron a külső energiaszinten az elemek atomjai a csoportszám:
1) II; 2) III; 3) vi; 4) IV.
5. A magasabb oxid-klór képlete:
1) sl 2 o; 2) CL 2O 3;
3) CL 2O 5; 4) CL 2O 7.
6. Az alumínium atom valenciája:
1) 1; 2) 2; 3) 3; 4) 4.
7. A VI. Csoport elemeinek illékony hidrogénvegyületeinek teljes képlete:
1) hu 4; 2) hu 3;
3) ne; 4) H 2 E.
8. A külső elektronikus réteg a kalciumatomban:
1) 1; 2) 2; 3) 3; 4) 4.
9.
1) Li; 2) na; 3) k; 4) CS.
10. Elemek-fémek megadása:
1) k; 2) Cu; 3) o; 4) N.
11. Ahol a D.I. Imeleeva, az elemek találhatók, amelyek atomjai kémiai reakciókban csak elektronokat adnak?
1) a II. Csoportban;
2) a 2. periódus elején;
3) a második időszak közepén;
4) a Via-csoportban.
12.
2) ve, mg; Al;
3) mg, CA, SR;
13. A nem metalikus elemek megadása:
1) Cl; 2) s; 3) mn; 4) mg.
14. Nem fémes tulajdonságok növekednek egymás után:
15. Mi az atomváltozás jellemzői időszakosan?
1) Nucleus atom;
2) az atomenergia-szintek száma;
3) a külső energiaszintű elektronok száma;
4) A neutronok száma.
16.
1-től; 2) al; 3) p; 4) Cl.
17. A rendszermag díjazásának növekedésével, az elemek atomjainak sugarai:
1) csökken;
2) Ne változtassa meg;
3) Növelje;
4) Rendszeresen változik.
18. Az egyik elem atomjainak izotópjai eltérnek:
1) a neutronok száma;
2) a protonok száma;
3) a valencia elektronok száma;
4) A D.I. Imendeeva táblázatban szereplő rendelkezés.
19. A neutronok száma az Atom rendszermagban 12 s:
1) 12; 2) 4; 3) 6; 4) 2.
20. Az elektronok eloszlása \u200b\u200baz energiaszintekkel a fluoratomban:
1) 2, 8, 4; 2) 2,6;
3) 2, 7; 4) 2, 8, 5.
2. lehetőség.
Feladatok. Válasszon ki egy vagy két helyes választ.
21. A 35 sorszámmal rendelkező elem:
1) 7. időszak, IVA csoport;
2) 4. időszak, VIIa Csoport;
3) 4. időszak, VIIb csoport;
4) 7. időszak, IVB csoport.
22. Az Atom +9 nukleuszának töltésével ellátott elem szekvenciaszámmal rendelkezik:
1) 19; 2) 10; 3) 4; 4) 9.
23. A semleges atom protonjai száma egybeesik:
1) a neutronok száma;
2) atomi tömeg;
3) a szekvencia szám;
4) Az elektronok száma.
24. Öt elektron a külső energiaszinten az elemek atomjai csoportszám:
1) I; 2) III; 3) v; 4) VII.
25. A magasabb nitrogén-oxid képlete:
1) n 2 o; 2) n 2 o 3;
3) n 2 o 5; 4) Nem;
26. A legmagasabb hidroxidban a kalcium atom valenciája egyenlő:
1) 1; 2) 2; 3) 3; 4) 4.
27. A hidrogénvegyületben az arzén atom valenciája:
1) 1; 2) 2; 3) 3; 4) 4.
28. A kálium atom külső elektronikai rétegének száma:
1) 1; 2) 2; 3) 3; 4) 4.
29. Az atom legnagyobb sugarája az elemből:
1) b; 2) o; 3) c; 4) N.
30. Elemek-fémek megadása:
1-től; 2) h; 3) f; 4) Cu.
31. Az elemek atomjai, amelyek képesek mind az elektronok bevételére, mind az elektronokra,
1) az IA-csoportban;
2) a Via-csoportban;
3) a második időszak elején;
4) A 3. időszak végén.
32.
1) Na, K, Li; 2) AL, MG, NA;
3) p, s, Сl; 4) Na, mg, al.
33. A nem metalikus elemek megadása:
1) na; 2) mg; 3) si; 4) P.
34.
35. A kémiai elem fő jellemzője:
1) atomtömeg;
2) a mag töltése;
3) az energiaszintek száma;
4) A neutronok száma.
36. Az elem szimbóluma, amelynek atomjai amfoteroxidot alkotnak:
1) n; 2) k; 3) s; 4) Zn.
37. A kémiai elemek periódusos rendszerének fő alcsoportjaiban, a mag, az atom sugarának növekedésével:
1) növeli;
2) csökken;
3) nem változik;
4) időszakosan változik.
38. Az atom magjában lévő neutronok száma:
1) az elektronok száma;
2) a protonok száma;
3) a relatív atomtömeg és a protonok száma közötti különbség;
4) Atom tömeg.
39. A hidrogén izotópok különböznek a számban:
1) elektronok;
2) neutronok;
3) protonok;
4) pozíció a táblázatban.
40. Az elektronok eloszlása \u200b\u200baz energiaszintekkel a nátrium-atomban:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5.
3. lehetőség.
Feladatok. Válasszon ki egy vagy két helyes választ.
41. Adja meg az IVA Csoportban található elem sorszámát, a D.I. IVELEEVA 4. táblázat 4. periódusát:
1) 24; 2) 34; 3) 32; 4) 82.
42. A 13 elem atommagjának nukleuszának díja:
1) +27; 2) +14; 3) +13; 4) +3.
43. Az atomok elektronjai száma:
1) a neutronok száma;
2) a protonok száma;
3) atomi tömeg;
4) a sorszám száma.
44. A csoport IVA elemei atomjai, a Valence elektronok száma:
1) 5; 2) 6; 3) 3; 4) 4.
45. Az R 2O 3 általános képletű oxidok a sorozat elemei:
1) Na, K, Li; 2) mg, ca, legyen;
3) B, AL, GA; 4) C, SI, GE.
46. A foszforatom legmagasabb oxidjában a foszforatom valenciája:
1) 1; 2) 3; 3) 5; 4) 4.
47. A VIIa Csoport elemeinek hidrogénvegyületei:
1) HCLO 4; 2) hcl;
3) HBRO; 4) HBR.
48. A Selena atom elektronikus rétegeinek száma:
1) 1; 2) 2; 3) 3; 4) 4.
49. Az atom legnagyobb sugarája az elemből:
1) Li; 2) na; 3) mg;
50. Elemek-fémek megadása:
1) na; 2) mg; 3) si; 4) P.
51. Az atomok, amelyek elemei könnyen adhatnak elektronokat?
1) k; 2) Cl; 3) na; 4) S.
52. Számos olyan elem, amelyben a fém tulajdonságok növekednek:
1) C, N, B, F;
2) al, si, p, mg;
53. A nem metalikus elemek megadása:
1) na; 2) mg; 3) n; 4) S.
54. Számos olyan elem, amelyben a nem fémes tulajdonságok növekednek:
1) Li, Na, K, N;
2) al, si, p, mg;
3) C, N, O, F;
4) Na, Mg, Al, K.
55. Az atom magjának növekedésével az elemek nem fémes tulajdonságai:
1) időszakosan változik;
2) amplifikált;
3) Ne változtassa meg;
4) gyengíti.
56. Az elem szimbóluma, amelynek atomjai amfoter hidroxidot képeznek:
1) na; 2) al; 3) n; 4) S.
57. Az elemek és a vegyületek tulajdonságainak megváltoztatásának gyakorisága magyarázható:
1) a külső elektronikus réteg szerkezetének ismétlése;
2) az elektronikus rétegek számának növekedése;
3) a neutronok számának növekedése;
4) az atomi tömeg növekedése.
58. A nátrium-atom magjában lévő protonok száma:
1) 23; 2) 12; 3) 1; 4) 11.
59. Mi a különbség az egyik elem izotópjai atomjai között?
1) a protonok száma;
2) a neutronok száma;
3) az elektronok száma;
4) a rendszermag díja.
60. Az elektronok eloszlása \u200b\u200baz energiaszintekkel a lítiumatomban:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5;
4. lehetőség.
Feladatok. Válasszon ki egy vagy két helyes választ.
61. A 29 sorszámmal rendelkező elem a következő:
1) 4. időszak, IA csoport;
2) 4. periódus, az IB-csoport;
3) 1. időszak, IA csoport;
4) 5. időszak, IA csoport.
62. A 15. számú elem nukleuszának díja:
1) +31; 2) 5; 3) +3; 4) +15.
63. Az atommag töltését a következők határozzák meg:
1) az elem sorszáma;
2) csoportszám;
3) az időszak száma;
4) Atom tömeg.
64. A csoport III elemei atomjainál a Valence elektronok száma:
1) 1; 2) 2; 3) 3; 4) 5.
65. A legmagasabb kén-oxid képlete:
1) h 2, 3; 2) h 2, 4;
3) így 3; 4) Tehát 2.
66. A magasabb foszfor-oxid képlete:
1) p 2 o 3; 2) h 3 PO 4;
3) NRU 3; 4) P 2 O 5.
67. A nitrogénatom értékelése hidrogénvegyületében:
1) 1; 2) 2; 3) 3; 4) 4.
68. A D.I. Remeeleeeva időtartama az atom következő jellemzőjének felel meg:
1) a Valence elektronok száma;
2) nagyobb valencia az oxigénnel rendelkező vegyületben;
3) az elektronok teljes száma;
4) Az energiaszintek száma.
69. Az atom legnagyobb sugarája az elemből:
1) Cl; 2) BR; 3) I; 4) F.
70. Elemek-fémek megadása:
1) mg; 2) Li; 3) h; 4) S.
71. Az atom atomjánál könnyebben adhat egy elektronot?
1) nátrium; 2) cézium;
3) kálium; 4) Lítium.
72. A fém tulajdonságai egymás után növekednek:
1) Na, MG, AL; 2) Na, K, Rb;
3) RB, K, NA; 4) P, S, Cl.
73. A nem metalikus elemek megadása:
1) Cu; 2) in; 3) n; 4) Kr. |
74. N-P-AS-SB nem fémes tulajdonságok:
1) csökken;
2) Ne változtassa meg;
3) Növelje;
4) Csökkentse, majd növelje.
75. Milyen jellegzetesen változik az atom?
1) relatív atomi tömeg;
2) a mag töltése;
3) az atomenergia-szintek száma;
4) Az elektronok száma a külső szinten.
76. Az atomok, amelyek elemei az amfoteroxidot alkotják?
1-től; 2) ve; 3) c; 4) SA.
77. Az atommagjának növekedésével járó időszakban növeli az elektronok vonzerejét a kernel és a fém tulajdonságaihoz:
1) amplifikált;
2) időszakosan változik;
3) gyengíti;
4) Ne változtassa meg.
78. Az elem relatív atomi tömege numerikusan egyenlő:
1) a protonok száma a magban;
2) a kernelben lévő neutronok száma;
3) a neutronok és protonok teljes száma;
4) Az atomok elektronjai száma.
79. Az atommagban lévő neutronok száma 16 o:
1) 1; 2) 0; 3) 8; 4) 32.
80. Az elektronok eloszlása \u200b\u200baz energiaszinteken a szilícium atomjában:
1) 2, 8, 4; 2) 2, 6;
3) 2, 7; 4) 2, 8, 5.
A tudás ellenőrzött elemei listája a témában
"Időszakos törvény. Az atom szerkezete
(Zárójelben van megadva munkaszámok)
Az elem (1, 3, 21, 41, 61) sorszáma, az atom (2, 22, 42, 62, 63) nukleuszának töltése, a protonok száma (23) és az elektronok száma (43) az atomon.
Csoportszám, elektronok a külső energiaszinten (4, 24, 44, 64), magasabb oxid-formulák (5, 25, 45, 65), az elem (6, 26, 46, 66), a képletek legmagasabb valenciája hidrogénvegyületek (7, 27, 47, 67).
Időszak száma, elektronikus szintek száma (8, 28, 48, 68).
Változtassa meg az atom sugarát (9, 17, 29, 37, 49, 67, 69).
Pozíció a D.I. táblázatban. Remefeleeva elemek-fémek (10, 30, 50, 70) és nem fém elemek (13, 33, 53, 73).
Az atomok képesek az elektronok megadására és elfogadására (11, 31, 51, 71).
Az egyszerű anyagok tulajdonságainak megváltoztatása: csoportok (12, 14, 34, 52, 54, 74) és időszakok (32, 72, 77).
Időszakos változás az atomok és az egyszerű anyagok és vegyületek tulajdonságainak elektronikus szerkezetében (15, 35, 55, 57, 75, 77).
Amfoteri-oxidok és hidroxidok (16, 36, 56, 76).
Tömegszám, az atom, izotópok (18, 19, 38, 39, 58, 59, 78, 79) protonok és neutronok száma.
Az elektronok eloszlása \u200b\u200baz atomok energiaszintjén (20, 40, 60, 80).
Válaszok a témák tesztelésére
"Időszakos törvény. Az atom szerkezete
| 1.opció | 2. lehetőség. | 3. lehetőség. | 4. lehetőség. | ||||
|---|---|---|---|---|---|---|---|
| Küldetés szám | Válaszszám | Küldetés szám | Válaszszám | Küldetés szám | Válaszszám | Küldetés szám | Válaszszám |
| 1 | 4 | 21 | 2 | 41 | 3 | 61 | 2 |
| 2 | 2 | 22 | 4 | 42 | 3 | 62 | 4 |
| 3 | 1, 2 | 23 | 3, 4 | 43 | 2, 4 | 63 | 1 |
| 4 | 3 | 24 | 3 | 44 | 4 | 64 | 3 |
| 5 | 4 | 25 | 3 | 45 | 3 | 65 | 3 |
| 6 | 3 | 26 | 2 | 46 | 3 | 66 | 4 |
| 7 | 4 | 27 | 3 | 47 | 2, 4 | 67 | 3 |
| 8 | 4 | 28 | 4 | 48 | 4 | 68 | 4 |
| 9 | 4 | 29 | 1 | 49 | 5 | 69 | 3 |
| 10 | 1, 2 | 30 | 1, 4 | 50 | 1, 2 | 70 | 1, 2 |
| 11 | 1, 2 | 31 | 2, 4 | 51 | 1, 3 | 71 | 2 |
| 12 | 3 | 32 | 2 | 52 | 3 | 72 | 2 |
| 13 | 1, 2 | 33 | 3, 4 | 53 | 3, 4 | 73 | 2, 3 |
| 14 | 1 | 34 | 4 | 54 | 3 | 74 | 1 |
| 15 | 3 | 35 | 2 | 55 | 1 | 75 | 4 |
| 16 | 2 | 36 | 4 | 56 | 2 | 76 | 2 |
| 17 | 1 | 37 | 1 | 57 | 1 | 77 | 3 |
| 18 | 1 | 38 | 3 | 58 | 4 | 78 | 3 |
| 19 | 3 | 39 | 2 | 59 | 2 | 79 | 3 |
| 20 | 3 | 40 | 2 | 60 | 1 | 80 | 1 |
Irodalom
Gorodnichev i.n.. A kémia ellenőrzése és ellenőrzése. M.: Akvárium, 1997; Sorokin v.v., Zlotnikov e.g. Kémiai tesztek. M.: Oktatás, 1991.
Bróm.1s. 2 2s. 2 2p. 6 3s. 2 3p. 6 3d. 10 4s. 2 4p. 5 .
Valence elektronok merészek lesznek. Utal a P-elemek családjára. Mivel a legnagyobb fő kvantumszám 4., és a külső energiaszintű elektronok száma 7, a bróm a 4. periódusban található, az időszakos táblázat VIIIa. Csoportja. A Valence elektronok energia diagramja az űrlapon van:
Germánium.
1s. 2 2s. 2 2p. 6 3s. 2 3p. 6 3d. 10 4s. 2 4p. 2 .
Valence elektronok merészek lesznek. Utal a P-elemek családjára. Mivel a legnagyobb fő kvantumszám 4., és a külső energiaszintű elektronok száma 4, a germánium a 4. periódusban található, IVA-csoport időszakos asztal. A Valence elektronok energia diagramja az űrlapon van:

Kobalt.
1s. 2 2s. 2 2p. 6 3s. 2 3p. 6 3d. 7 4s. 2 .
Valence elektronok merészek lesznek. A D-elemek családjára utal. A Cobalt a 4. periódusban található, az időszakos táblázat Viib csoportja. A Valence elektronok energia diagramja az űrlapon van:

Réz.
1s. 2 2s. 2 2p. 6 3s. 2 3p. 6 3d. 10 4s. 1 .
Valence elektronok merészek lesznek. A D-elemek családjára utal. Mivel a legnagyobb fő kvantumszám 4., és a külső energiaszintű elektronok száma 1, a réz a 4. periódusban helyezkedik el, I az időszakos asztalcsoportban. Az elektronok energia diagramja az űrlapon van.
Koncepció Átmeneti elem Általában a D-vagy F elektronok bármely elemének kijelölésére szolgál. Ezek az elemek átmeneti helyzetet foglalnak el az elektromos S-elemek és az elektrongatív P-elemek között az időszakos táblázatban.
a D-elemek szokásos, a fő átmeneti elemeknek nevezik. Atomjaikat a D-tengeralattjárók belső épülete jellemzi. Az a tény, hogy a külső héj sz-orbitálja általában kitölti, mielőtt a D-orbitálok töltése az előző elektronhéjban kezdődik. Ez azt jelenti, hogy minden új elektron, hozzáadva a következő D-elem elektronikus héjához, a töltés elvének megfelelően, nem esik a külső héjra, de a belső tengeralattjáróra. Ezen elemek kémiai tulajdonságait a meghatározott héjak elektronjaiban való részvétel határozza meg.

a D-elemek három átmeneti sorokat alkotnak - a 4., 5. és 6. időszakban. Az első átmeneti tartomány 10 elemet tartalmaz Skandiumtól a cinkig. Ez jellemzi a 3D-es pályák belső épületét. A 4-es orbitálok korábban vannak kitöltve, mint a 3D Orbital, Mert kevesebb energiával rendelkezik (CLEKKOVSKY szabály).
Mindazonáltal meg kell jegyeznie két anomáliát. A Chrome és a réz csak egy elektronja van a 4-es orbitállal. A tény az, hogy a félig töltött vagy teljesen töltve sublicas nagyobb stabilitást biztosít, mint részben töltött submaroes.
A krómatomban mind az öt 3D-s orbitálok mindegyikében 3D tengeralattjárót alkotnak, van egy elektron. Egy ilyen tengeralattjáró félig tele van. A réz atomban az öt 3D-s orbital mindegyike az elektronpárban található. Hasonló anomália az ezüstben megfigyelhető.
Minden D-elem fém.
A negyedik időszak elemeinek elektronikus konfigurációi a skandiumtól a cinkig: 


Króm
A Chrome a 4. periódusban, a VI csoportban, egy oldalsó alcsoportban. Ez egy közepes aktivitás fém. A vegyületeiben a króm a +2, +3 és +6 oxidáció mértékét mutatja. A CRO egy tipikus fő oxid, CR 2O 3 - amfoteroxid, CRO 3 - tipikus savas oxid, erős oxidálószer tulajdonságaival, azaz az oxidáció növekedésével a savas tulajdonságok növekedésével járnak.

Vas
A vas a 4. periódusban van a VIII. Csoportban, egy oldalsó alcsoportban. Vas - fémmém, vegyületeiben a legjelentősebb oxidációs fok +2 és +3. A vasvegyületek is ismertek is, amelyekben az oxidáció mértéke +6, amelyek erős oxidálószerek. FEO mutatja a fő, és a Fe 2 o 3 az amfoter, az alapvető tulajdonságok túlsúlyával.

Réz
A réz a 4. periódusban, az én csoportban, egy oldalsó alcsoportban. A legstabilabb oxidációs fok +2 és +1. A fémek számos feszültségében a réz hidrogénatom után történik, kémiai aktivitása nem túl nagy. Réz-oxidok: Cu2o Cuo. Az utóbbi és a réz cu (OH) 2 hidroxidja amfoter tulajdonságokat mutat a fő dominanciájával.
Cink
A cink a 4. periódusban van a II csoportban, egy oldalsó alcsoportban. A cink a közepes aktivitás fémjeire vonatkozik, a vegyületeiben az egyetlen oxidáció + 2 fok. Az oxid és a cink-hidroxid az amfoter.
Egy időszakos törvény modern megfogalmazása, amelyet D. I. Mendeleev 1869-ben nyit meg:
Az elemek tulajdonságai a szekvenciaszám időszakos függőségében vannak.
Az elemek elektronikus héjának összetételének módosításának időszakos megismételt természete megmagyarázza az elemek tulajdonságainak időszakos változását, amikor az időszakos rendszer időszakaiban és csoportjai között mozog.
Például a legmagasabb és alacsonyabb oxidációs változások az IA-VIIA csoportokban az asztal második negyedik időszakában. 3.
Pozitív Az oxidáció mértéke az összes elemet mutatja, kivéve a fluoridot. Értékük növekszik a házimunkák növekedésével, és egybeesik az elektronok számával az utolsó energiaszinten (oxigén kivételével). Ezeket az oxidációs fokokat hívják magas Oxidációs fok. Például a foszfor p-os oxidációja egyenlő + v.

Negatív A oxidációs fokú mutatnak elemek, kezdve a szén C, szilícium Si és Németországban a GE. Az ezek értékei megegyeznek az elektronok számával, amelyek legfeljebb nyolcig hiányoznak. Ezeket az oxidációs fokokat hívják Alsó Oxidációs fok. Például az utolsó energiaszintű foszforatom három elektronot tartalmaz nyolcra, ez azt jelenti, hogy a foszfor p-oxidációja egyenlő - III.
A legmagasabb és az alacsonyabb oxidáció értékét időszakosan megismételjük, egybeesik a csoportokban; Például az IVA-csoportban a szén C, a SILICON SI és a Germanium GE a + IV-os oxidációval rendelkezik, és az alacsonyabb oxidációs fok.
Az oxidációs fok változása gyakorisága tükröződik a kémiai vegyületek összetételének és tulajdonságainak időszakos változása.
Hasonlóképpen nyomon követhető az elemek elektrotechnezékenységének időszakos változása az IA-VIIA csoportok 1-6. periódusában (4. táblázat).
Az időszakos rendszer minden egyes időszakában az elemek elektronnegabilitása növekszik a szekvencia szám növekedésével (balról jobbra).

Az összesben csoport Időszakos rendszer A villamos energia csökken a sorozatszám növekedésével (felülről lefelé). Fluor F a legmagasabb, és a cézium-CS a legalacsonyabb electronegitability elemei között a 1-6 időszakokban.
Tipikus nemfémek - magas elektrotrikát és tipikus fémek - alacsony.
Példák az A részekre vonatkozó hozzárendelésekre1. A 4. periódusban az elemek száma egyenlő
2. A 3. periódus elemeinek fém tulajdonságai NA-tól CL-ig
1) csend
2) gyengíti
3) Ne változtassa meg
4) Nem tudom
3. A halogének nem fémes tulajdonságai a szekvencia szám növekedésével
1) Növelje
2) friss
3) változatlan marad
4) Nem tudom
4. Számos Zn elemen - HG - CO-CD egy elem, amely nem szerepel a csoportban
5. Az elemek fém tulajdonságai egymás után emelkednek
1) In - Ga - Al
2) K - RB - SR
3) GE - GA - TL
4) Li - MG
6. Nem fémes tulajdonságok egy sor elemben Al - Si - C - N
1) Növelje
2) Csökkent
3) Ne változtassa meg
4) Nem tudom
7. Számos elemben O - S - SE - ezek a méretek (RuDi) atom
1) Csökkent
2) Növelje
3) Ne változtassa meg
4) Nem tudom
8. Számos elemben P - Si - Al - Mg Méretek (RuDi) Atom
1) Csökkent
2) Növelje
3) Ne változtassa meg
4) Nem tudom
9. Foszforelemhez Kevesebb Villamos energia
10. Molekula, amelyben az elektronikus sűrűség a foszforatomra tolódik - ez
11. magasabb Az elemek oxidációjának mértéke az oxidok és a fluoridok halmazában nyilvánul meg
1) CLO 2, RSL 5, Secl 4, SO 3
2) PCL, AL 2O 3, KSL, a
3) SEO 3, HVL 3, N 2O 5, SASL 2
4) ASCL 5, SEO 2, SCL 2, CL 2O 7
12. A legalacsonyabb Az elemek oxidációjának mértéke - hidrogénvegyületükben és a fluoridok tárcsázásában
1) CLF 3, NH 3, NAH, 2
2) H 3 S +, NH +, SIH 4, H 2 SE
3) CH 4, BF 4, H3 O +, PF 3
4) pH 3, NF +, HF 2, CF 4
13. Valence egy multifaceted atomra Ugyanaz Számos kapcsolatban
1) SIH 4 - Ash 3 - CF 4
2) pH 3 - BF 3 - CLF 3
3) ASF 3 - SICL 4 - Ha 7
4) H 2 O - BCLG - NF 3
14. Adja meg az anyag vagy ion képlete és a szén oxidáció mértéke közötti levelezést